
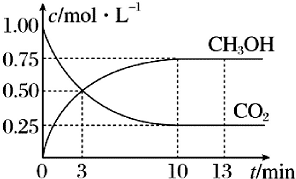
 已知:CO2(g)+3H2(g)?CH5OH(g)+H2O(g)△H=-49.0kJ•mol-1一定条件下,向体积为1L的恒容密闭容器中充入1mol CO2和3mol H2,测得CO2(g)和CH3OH(g)的浓度随时间变化曲线如图所示,下列叙述中正确的是( )
已知:CO2(g)+3H2(g)?CH5OH(g)+H2O(g)△H=-49.0kJ•mol-1一定条件下,向体积为1L的恒容密闭容器中充入1mol CO2和3mol H2,测得CO2(g)和CH3OH(g)的浓度随时间变化曲线如图所示,下列叙述中正确的是( )| A. | 3min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率 | |
| B. | 从反应开始到平衡,H2的平均反应速率v(H2)=0.225mol•L-1•min-1 | |
| C. | 13min时,向容器中充入2mol氦气,该反应的化学反应速率增大 | |
| D. | 13min时,向容器中充入2mol CO2,该反应化学平衡常数增大 |
分析 A、3 min时,CH3OH和CO2的浓度相等,但反应没有达到平衡状态.
B、根据v=$\frac{△c}{△t}$计算其平均反应速率;
C、13min时,向容器中充入2mol氦气,体积不变,各组分浓度不变;
D、平衡常数只受温度的影响,和浓度无关.
解答 解:A、3 min时,CH3OH和CO2的浓度相等,但是并没有达到平衡,所以速率不相等,故A错误.
D、从反应开始到平衡,二氧化碳的平均反应速率=$\frac{1.00-0.25}{10}$ mol•L-1•min-1=0.075 mol•L-1•min-1,H2的平均反应速率υ(H2)=0.225mol•L-1•min-1,故B正确;
C、13min时,向容器中充入2mol氦气,体积不变,各组分浓度不变,所以反应速率不变,故C错误;
D、平衡常数只受温度的影响,和浓度无关,向容器中充入2mol CO2,该反应化学平衡常数不变,故D错误.
故选B.
点评 本题考查了图象分析题,难度不大,注意转化率的计算方法、外界条件对化学平衡的影响、化学反应速率的计算等问题.


科目:高中化学 来源: 题型:选择题
| A. | 处理废水中的Cr2O72-的物质的量为nx | |
| B. | 反应中发生转移的电子数为6nxmol | |
| C. | 在FeO•FeyCrxO3中,y=3x=$\frac{3}{2}$ | |
| D. | 消耗硫酸亚铁的物质的量为n(2-x) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将海水淡化和与浓海水资源化结合起来是综合利用海水的重要途径之一.一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺提取其他产品.
将海水淡化和与浓海水资源化结合起来是综合利用海水的重要途径之一.一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺提取其他产品.| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 相关信息 | |
| A | 所处的周期数、族序数分别与其原子序数相等 |
| B | 核外有3种不同原子轨道,每个轨道容纳的电子数相等 |
| C | 基态时,2p轨道处于半充满状态 |
| D | 与C元素处于同一周期,且D的第一电离能小于C的第一电离能 |
| E | 是目前生产、生活中应用最广泛的金属 |

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 我国以三个强度等级(42.5、52.5、62.5)表示水泥的性能,等级越高性能越好 | |
| B. | 光导纤维的主要成分是石英玻璃 | |
| C. | 新型陶瓷分成两大类,即结构陶瓷(如纳米陶瓷)和功能陶瓷(如生物陶瓷) | |
| D. | 在玻璃中加入金属氧化物,可以使玻璃呈现颜色,例如加入氧化亚铜(Cu2O)呈蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com