
| A. | 溶液中加水,$\frac{c(HC{O}_{3}^{-})•c(O{H}^{-})}{c(C{O}_{3}^{2-})}$增大 | |
| B. | 加入Na2CO3固体,$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$减小 | |
| C. | 升高温度,平衡常数减小 | |
| D. | 通入CO2,溶液pH增大 |
分析 碳酸钠溶液中,碳酸根离子存在水解平衡:CO32-+H2O?HCO3-+OH-,
A.$\frac{c(HC{O}_{3}^{-})•c(O{H}^{-})}{c(C{O}_{3}^{2-})}$为碳酸根离子的水解平衡常数,温度不变,则该比值不变;
B.加入碳酸钠过量,碳酸根离子的浓度增大幅度大于碳酸根离子的水解程度,则溶液中$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$的比值减小;
C.盐的水解为吸热反应,升高温度后水解程度增大,水解平衡向着正向移动,导致平衡常数增大;
D.通入二氧化碳后,碳酸根离子浓度减小,溶液的pH减小.
解答 解:A.溶液中加水,由于温度不变,则碳酸根离子的水解平衡常数$\frac{c(HC{O}_{3}^{-})•c(O{H}^{-})}{c(C{O}_{3}^{2-})}$不会发生变化,故A错误;
B.加入Na2CO3固体,溶液中碳酸根离子浓度增大,由于水解程度较小,则溶液中碳酸根离子的浓度增大程度大于碳酸氢根离子,所以$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$的比值会减小,故B正确;
C.升高温度后,碳酸根离子的水解平衡向着正向移动,则该水解平衡常数会增大,故C错误;
D.碳酸钠溶液中通入二氧化碳,反应生成碳酸氢钠,碳酸根离子浓度减小,溶液的pH减小,故D错误;
故选B.
点评 本题考查了盐的水解原理及其影响,题目难度中等,明确影响盐的水解的因素为解答关键,注意掌握电离平衡常数的概念及其影响,试题有利于培养学生的分析、理解能力.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:解答题
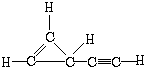 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
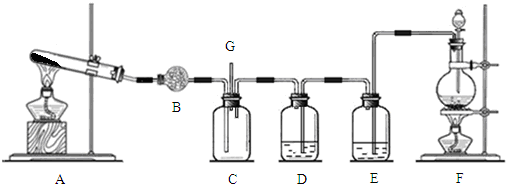
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
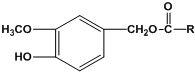 (R为烃基)
(R为烃基)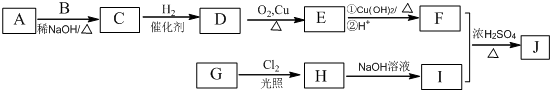
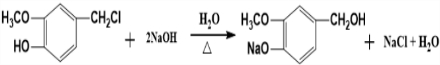 .
. .
.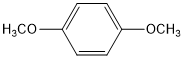 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn为正极,Cu为负极,CuCl2溶液作电解质溶液 | |
| B. | Cu为正极,Zn为负极,稀H2SO4作电解质溶液 | |
| C. | Cu为正极,Zn为负极,CuSO4溶液作电解质溶液 | |
| D. | Fe为正极,Zn为负极,ZnSO4溶液作电解质溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
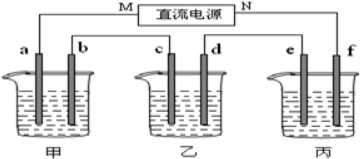
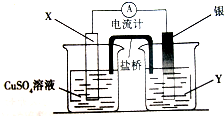
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
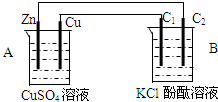 按如图装置进行实验,并回答下列问题
按如图装置进行实验,并回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 120mL | B. | 150mL | C. | 200mL | D. | 220mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com