
| 溶质 | Na2CO3 | NaHCO3 | Na2SiO3 | Na2SO3 | NaHSO3 | NaClO |
| pH | 11.6 | 9.7 | 12.3 | 10.0 | 4.0 | 10.3 |
分析 (1)依据溶液Na2CO3,Na2SiO3,NaClO,Na2SO3的PH分析,亚硫酸是中强酸,同主族最高价含氧酸从上到下依次减弱;
(2)增大氯水中次氯酸浓度选择试剂和盐酸反应不能和次氯酸反应;
(3)NaClO溶液中通入少量CO2,生成碳酸氢钠和次氯酸;
(4)弱酸的电离程度和弱酸根的水解程度都很小,H2SO3和NaHSO3混合液能够形成缓冲溶液.
解答 解:(1)盐溶液的pH越大,盐的水解程度越大,盐的水解程度越大的盐对应酸的酸性越弱,由溶液Na2CO3,Na2SiO3,NaClO,Na2SO3的PH可知,酸性:B>C>D>A;
故答案为:B>C>D>A;
(2)Na2CO3、Na2SiO3、Na2SO3水解显碱性和盐酸反应也可以和次氯酸反应不能增大次氯酸浓度,加入NaClO和盐酸反应生成次氯酸,平衡正向进行,增大次氯酸浓度;加入NaHCO3,和盐酸反应促进平衡正向进行,增大次氯酸浓度;加入NaHSO3能被次氯酸氧化,次氯酸浓度减小;
故答案为:NaHCO3或NaClO;
(3)NaClO溶液中通入少量CO2,生成碳酸氢钠和次氯酸,其反应的化学方程式为:NaClO+CO2+H2O=HClO+NaHCO3;
故答案为:NaClO+CO2+H2O=HClO+NaHCO3;
(4)向H2SO3和NaHSO3混合液中加入少量强酸时,能够生成亚硫酸,加入少量强碱时,能够生成亚硫酸氢根离子,溶液的pH变化不大,
故答案为:加碱发生反应:H2SO3+OH-═HSO3-+H2O; 加酸发生反应:HSO3-+H+═H2SO3.
点评 本题考查了盐类水解的应用,溶液pH的大小和溶液酸碱性的分析判断依据,化学平衡的移动原理分析,注意次氯酸的弱酸性和盐溶液的酸碱性实质,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{1}^{1}$He | B. | ${\;}_{2}^{3}$He | C. | ${\;}_{2}^{5}$He | D. | ${\;}_{2}^{1}$He |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
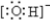 ,B转化为C的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
,B转化为C的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨燃料电池在放电时,氨气被氧化 | |
| B. | 氨燃料电池在放电时,正极反应为:2NH3+6e-+6OH-=N2+6H2O | |
| C. | 以氨气代替氢气的主要原因是:氨气易液化易储存 | |
| D. | 氨燃料电池产物为无污染的氮气和水,属于环境友好电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
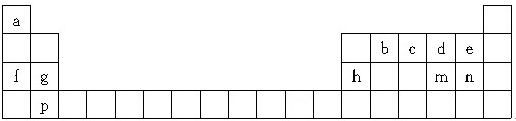
 ,其中含有的
,其中含有的查看答案和解析>>
科目:高中化学 来源: 题型:选择题
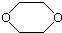 ,是一种常见的有机溶剂,它可以通过下列三步反应制得:
,是一种常见的有机溶剂,它可以通过下列三步反应制得:| A. | 烃A为CH3CH3 | B. | 反应②属于消去反应 | ||
| C. | 反应①②③都属于取代反应 | D. | 化合物D属于醚 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大D的浓度 | B. | 减小C的浓度 | C. | 减小B的浓度 | D. | 减小压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
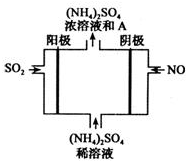 经研究发现,含pM2.5的雾霾主要成分有SO2、NOx、CxHy,及可吸入颗粒等.
经研究发现,含pM2.5的雾霾主要成分有SO2、NOx、CxHy,及可吸入颗粒等.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com