
分析 A气体为黄绿色,则A为Cl2,F气体为棕红色,则F为Br2,B和A气体混合后瓶壁上出现红棕色液滴,则B为HBr,把B、E瓶打开有白雾产生,则E为HCl,D和A混合后见强光爆炸,混合后强光照射下发生爆炸的是H2和Cl2,所以D为H2,则C为O2,据此答题.
解答 解:A气体为黄绿色,则A为Cl2,F气体为棕红色,则F为Br2,B和A气体混合后瓶壁上出现红棕色液滴,则B为HBr,把B、E瓶打开有白雾产生,则E为HCl,D和A混合后见强光爆炸,混合后强光照射下发生爆炸的是H2和Cl2,所以D为H2,则C为O2,
(1)根据上面的分析可知,A为Cl2,B为HBr,C为O2,D为H2,E为HCl,F为Br2,
故答案为:Cl2;HBr;O2;H2;HCl;Br2;
(2)①D+A反应的方程式为H2+Cl2$\frac{\underline{\;光照\;}}{\;}$2HCl,②A+B反应的方程式为2HBr+Cl2=2HCl+Br2,
故答案为:H2+Cl2$\frac{\underline{\;光照\;}}{\;}$2HCl;2HBr+Cl2=2HCl+Br2.
点评 本题考查气体的相关性质,难度不大,要注意平时的积累,牢记常见反应的现象.


科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8个中子的碳原子的核素符号:12C | B. | 乙烯分子的结构简式:CH2=CH2 | ||
| C. | Cl-离子的结构示意图: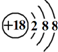 | D. | CH4分子的球棍模型: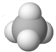 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 2 mol•L-1的醋酸钠溶液中CH3COO- 的数目小于2NA | |
| B. | 常温常压下,1.12 L O2气体所含原子数为0.1NA | |
| C. | 将2 mol NO和1 mol O2混合后,体系中的分子总数为3NA | |
| D. | 1 mol羟基含有的电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
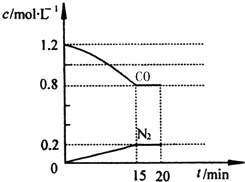
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 | |
| B. | 在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素 | |
| C. | 在金属元素区域可以寻找制备新型农药材料的元素 | |
| D. | 周期表中位置靠近的元素性质相似 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

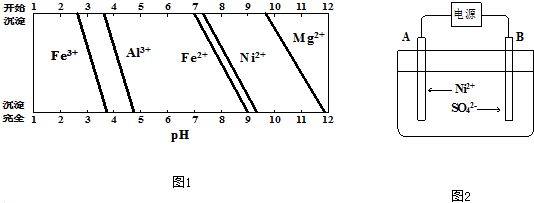
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇脱氧制取甲醛的原理为CH3OH(g)?HCHO(g)+H2(g),某科研小组在1L恒溶密闭容器中充入1molCH3OH,对该反应进行了一系列的研究,得到甲醇的平衡转化率随温度的变化曲线如图所示.
甲醇脱氧制取甲醛的原理为CH3OH(g)?HCHO(g)+H2(g),某科研小组在1L恒溶密闭容器中充入1molCH3OH,对该反应进行了一系列的研究,得到甲醇的平衡转化率随温度的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| B. | 苯酚钠溶液与少量二氧化碳反应:2C6H5O-+CO2+H2O→2 C6H5OH+CO32- | |
| C. | 在碳酸氢钠溶液中加入过量的氢氧化钡溶液:Ba2++OH-+HCO3-═BaCO3↓+H2O | |
| D. | 用氯化铁溶液和沸水反应制取氢氧化铁胶体:Fe3++3H2O(沸水)═Fe(OH)3↓+3H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com