
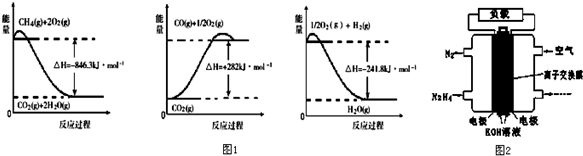
分析 (1)依据图象分析各个反应过程中能量变化情况,写出热化学方程式,依据盖斯定律计算CH4(g)与H2O(g)反应生成CO(g)和H2(g)的反应热,据此写出热化学方程式;
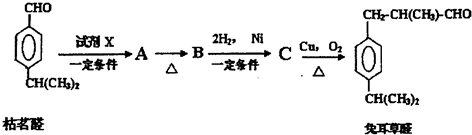
(2)该燃料电池中,负极上燃料失电子发生氧化反应,左侧为负极,电极反应式为:N2H4+4OH--4e-=N2↑+4H2O,正极上氧气得电子发生还原反应,右侧为正极,电极反应式为:O2+2H2O+4e-=4OH-,电池总反应为:N2H4+O2=N2↑+2H2O,结合离子的移动方向、电流的方向,电子守恒规律分析解答①②③;
④用惰性电极电极硫酸铜,阳极上水电离产生的氢氧根离子失去电子发生氧化反应,促进水的电离;
串联电路中电解池、原电池中各个电极上通过的电量相等,依据消耗32mg液态肼时,计算各个电极上转移的电子的数目,依据电解池阳极发生反应4OH--4e-=2H2O+O2↑,计算消耗的氢氧根离子,进而计算生成的氢离子的物质的量和物质的量浓度,依据pH计算公式求溶液pH值.
解答 解:(1)由图象分析反应过程都是能量降低的过程,说明反应是放热反应;反应的热化学方程式分别为:
①CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-846.3KJ/mol
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-282KJ/mol
③H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8KJ/mol
由盖斯定律①-③×3-②得到:CH4(g)+H2O(g)=CO(g)+3H2 (g)△H=+161.1kJ•mol-1,
故答案为:CH4(g)+H2O(g)=CO(g)+3H2 (g)△H=+161.1kJ•mol-1;
(2)①该燃料电池中,负极上燃料失电子发生氧化反应,左侧为负极,右侧为正极,电流从正极出发经过负载流向负极,
故答案为:右;左;
②负极上燃料失电子发生氧化反应,左侧为负极,电极反应式为:N2H4+4OH--4e-=N2↑+4H2O;
故答案为:N2H4+4OH--4e-=N2↑+4H2O;
③该原电池中,正极上生成氢氧根离子,所以离子交换膜要选取阴离子交换膜,
故答案为:阴离子;
④惰性电极电极硫酸铜溶液时,水中氢氧根离子在阳极上放电,不断消耗,促进了水的电离,使水的电离平衡向右移动;
依据N2H4+4OH--4e-=N2↑+4H2O可知消耗32g肼转移4mol电子,所以消耗32mg液态肼时,转移电子数为0.004mol,电极池中4OH--4e-=2H2O+O2↑,转移0.004mol电子,消耗0.004molOH-,同时生成0.004molH+,所以C(H+)=$\frac{0.004mol}{0.4L}$=0.01mol,溶液的pH=-lg[H+]=2;
故答案为:右;2.
点评 本题考查了热化学方程式的书写、燃料电池、电解池工作原理,熟悉盖斯定律计算反应热的方法和燃料电池、电解池工作原理是解题关键,注意有关电化学计算中电子守恒的应用.


 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:解答题
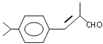 ;检验B中的官能团时,需先加入的试剂是新制氢氧化铜悬浊液;酸化后,再加入的试剂是溴水或高锰酸钾溶液.
;检验B中的官能团时,需先加入的试剂是新制氢氧化铜悬浊液;酸化后,再加入的试剂是溴水或高锰酸钾溶液. .
.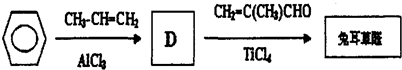
 .D→兔耳草醛的反应类型是加成反应.
.D→兔耳草醛的反应类型是加成反应. 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸镁晶体分解反应是放热反应 | B. | 氯化镁水解是熵增反应 | ||
| C. | 硫酸镁晶体分解反应是熵减反应 | D. | 氯化镁分解放热比硫酸镁少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl、NaClO | B. | NaCl、NaClO3 | C. | NaClO、NaClO3 | D. | NaClO3、NaClO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在蒸馏水中滴加浓H2SO4,KW不变 | |
| B. | 25℃时,在 c(H+)=$\sqrt{{K}_{W}}$的溶液中,大量存在Na+、S2-、NO3-、CO32-等离子 | |
| C. | 常温,0.1mol•L-1的NaHSO3溶液的pH=6,则c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-) | |
| D. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 方法一 | CO(g)+2H2(g)?CH3OH(g) |
| 方法二 | CO2(g)+3H2(g)?CH3OH(g)+H2O(g) |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol•L-1NaClO溶液中含有的ClO-数目为NA | |
| B. | 常温常压下,11.2 L Cl2含氯原子数为NA | |
| C. | 一定条件下,将1 mol N2和3 mol H2混合,充分反应后转移的电子数为6NA | |
| D. | 6.4 g由S2、S4、S8组成的混合物含硫原子数为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一定条件下,固定容积的密闭容器中,CO和H2反应生成甲醇:CO(g)+2H2(g)?CH3OH(g).如图是该反应在不同温度下CO的转化率随时间变化的曲线.下列判断正确的是( )
一定条件下,固定容积的密闭容器中,CO和H2反应生成甲醇:CO(g)+2H2(g)?CH3OH(g).如图是该反应在不同温度下CO的转化率随时间变化的曲线.下列判断正确的是( )| A. | T1>T2,该反应的△H>0 | |
| B. | 加入催化剂可以提高CO的转化率 | |
| C. | T1时的平衡常数K1>T2时的平衡常数K2 | |
| D. | CO(g)+2H2(g)?CH3OH(1)的△H值将变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 电渗析法是一种利用A、B离子交换膜进行海水淡化的方法,其原理如图所示.已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极.下列叙述中正确的是( )
电渗析法是一种利用A、B离子交换膜进行海水淡化的方法,其原理如图所示.已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极.下列叙述中正确的是( )| A. | 是原电池装置,把化学能转化为电能 | |
| B. | 是电解装置,只发生物理变化 | |
| C. | 左右池中得到淡水 | |
| D. | A膜是阴离子交换膜,B膜是阳离子交换膜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com