
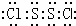 ,属极性分子(填极性或非极性).
,属极性分子(填极性或非极性).分析 (1)H2O2中存在O-O、O-H键;根据还原产物为水来分析;
(2)分子结构与H2O2类似,S2Cl2分子中S原子之间形成1对共用电子对,Cl原子与S原子之间形成1对共用电子对,S2Cl2是展开书页型结构,Cl-S位于两个书页面内,该物质结构不对称;
(3)二元弱酸分步电离,根据电离方程式的书写方法来回答;H2O2与Ba(OH)2作用生成过氧化钡和水;
(4)H2O2有还原性,能被酸性KMnO4溶液氧化生成水,KMnO4自身被还原成锰离子;
(5)酸性条件下,过氧化氢和铜反应生成水和铜离子;
(6)该晶体具有Na2CO3和H2O2的双重性质.
解答 解:(1)H2O2中存在O-O、O-H键,结构式为H-O-O-H;该氧化还原反应中还原产物为水,对环境无污染;
故答案为:H-O-O-H;还原产物为水,对环境无污染;
(2)由结构可知,S2Cl2分子中S原子之间形成1对共用电子对,Cl原子与S原子之间形成1对共用电子对,S2Cl2的电子式为 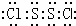 ,S2Cl2是展开书页型结构,Cl-S位于两个书页面内,该物质结构不对称,正负电荷重心不重合,为极性分子;
,S2Cl2是展开书页型结构,Cl-S位于两个书页面内,该物质结构不对称,正负电荷重心不重合,为极性分子;
故答案为: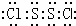 ;极性;
;极性;
(3)H2O2属于二元弱酸,电离方程式为:H2O2=H++HO2-,HO2-=H++O22-;H2O2与Ba(OH)2作用生成过氧化钡和水,其反应的方程式为:H2O2+Ba(OH)2═BaO2+2H2O;
故答案为:H2O2=H++HO2-,HO2-=H++O22-;H2O2+Ba(OH)2═BaO2+2H2O;
(4)H2O2还有一定的还原性,能被酸性KMnO4溶液氧化生成水,KMnO4自身被还原成锰离子,离子方程式为:5H2O2+2MnO4-+6H+=5O2↑+2Mn2++8H2O;
故答案为:5H2O2+2MnO4-+6H+=5O2↑+2Mn2++8H2O;
(5)酸性条件下Cu与过氧化氢发生氧化还原反应生成硫酸铜和水,离子反应为:H2O2+Cu+2H+=Cu2++2H2O;
故答案为:H2O2+Cu+2H+=Cu2++2H2O;
(6)该晶体具有Na2CO3和H2O2的双重性质,
A.H2O2在MnO2的作用下生成水和氧气,故A不选;
B.H2S与H2O2发生氧化还原反应生成单质硫和水,故B不选;
C.CH3COOH与Na2CO3反应放出二氧化碳气体,故C不选;
D.NaHCO3与Na2CO3和H2O2都不反应,不会使过碳酸钠失效,故D选;
故选D.
点评 本题考查较为综合,涉及电子式、分子的极性以氧化还原反应等知识,侧重于基本概念的理解,难度不大,注意基础积累.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铝可作胃酸的中和剂 | B. | 碳酸氢钠可作食品的膨松剂 | ||
| C. | 磁性氧化铁可作红色油漆和涂料 | D. | 钠钾合金可作原子反应堆的导热剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
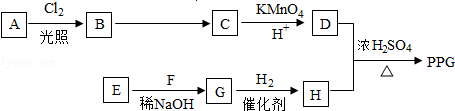
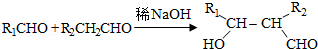
 .
.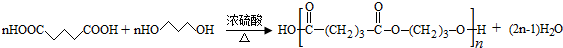 .
.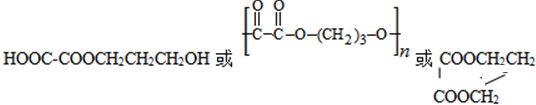 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c (A-)>c (B+)>c (H+)>c (OH-) | B. | c (B+)=c (A-)>c (H+)=c (OH-) | ||
| C. | c (OH-)-c (H+)=c(HA) | D. | c (B+)+c (H+)=c (A-)+c (OH-)+c(HA) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com