
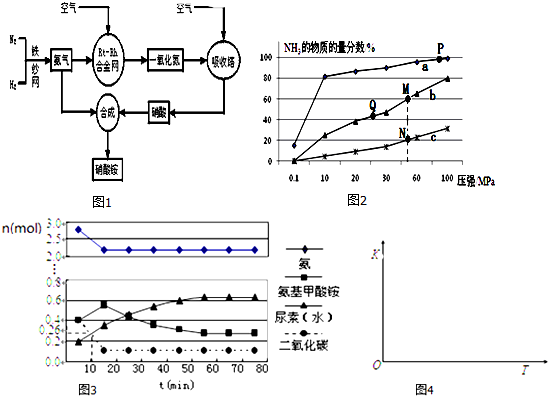
分析 (1)硝酸铵溶液中铵根离子水解,使溶液呈酸性;
(2)①正反应是放热反应,升高温度平衡逆向移动,氨气的含量减小;
②A.减小生成物浓度平衡正向移动;
B.P点原料气的平衡转化率接近100%,但此时压强为100MPa,高压对设备的要求太高,导致成本高,不是当前工业生产工艺中采用的温度、压强条件;
C.K只受温度影响,温度不变平衡常数不变,正反应为放热反应,升高温度平衡逆向移动,平衡常数减小;
D.M点时氨的物质的量的分数为60%,根据反应N2(g)+3H2(g)?2NH3(g)利用三段式计算;
E.计算平衡时各组分浓度,代入K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$计算平衡常数;
(3)已知:①2NH3(g)+CO2(g)═H2NCOONH4(s)△H=-272kJ•mol-1;
②H2NCOONH4(s)═CO(NH2)2(s)+H2O(g)△H=+138kJ•mol-1;
根据盖斯定律,①+②可得:2NH3(g)+CO2(g)?H2O(g)+CO(NH2)2 (s);
(4)①已知总反应的快慢由慢的一步决定,反应快慢可以依据第一步和第二步反应的曲线斜率比较大小;
②根据图象中二氧化碳在10 min时测得CO2的物质的量计算出用CO2表示的第一步反应的速率v(CO2);
③第二步反应为吸热反应,升高温度平衡向正反应方向移动,平衡常数增大.
解答 解:(1)硝酸铵溶液中铵根离子水解,会使溶液呈酸性,所以溶液中离子浓度大小关系是c(NO3-)>c(NH4+)>c(H+)>c(OH-),
故答案为:酸性;c(NO3-)>c(NH4+)>c(H+)>c(OH-);
(2)①合成氨的反应为放热反应,反应温度越高,越不利于反应正向进行,曲线a的氨气的物质的量分数最高,其反应温度对应相对最低,所以a曲线对应温度为200°C;
故答案为:200℃;
②A.及时分离出NH3,可以使平衡正向进行,可以提高H2的平衡转化率,故A正确;
B.P点原料气的平衡转化率接近100%,但此时压强为100MPa,高压对设备的要求太高,导致成本高,当前工业生产工艺中采用的500℃、20MPa~50MPa,故B错误;
C.平衡常数与温度有关,与其他条件无关,温度相同时平衡常数相同,反应是放热反应,温度越高平衡常数越小,则M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N),故C正确;
D.M点时氨的物质的量的分数为60%,利用三段式,设H2转化率是x
根据反应N2(g)+3H2(g)?2NH3(g)
起始 1 3 0
转化 x 3x 2x
平衡 1-x 3-3x 2x
$\frac{2x}{1-x+3-3x+2x}$=60%,所以x=0.75,故D正确;
E.N点时c(NH3)=0.2mol•L-1,氨气体积分数为20%,则:
N2(g)+3H2(g)?2NH3(g)
起始浓度(mol/L):x 3x 0
变化浓度(mol/L):0.1 0.3 0.2
平衡浓度(mol/L):x-0.1 3x-0.3 0.2
所以$\frac{0.2}{4x-0.2}$=20%,解得x=0.3,平衡常数K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$=$\frac{0.{2}^{2}}{0.2×0.{6}^{3}}$≈0.93,故E正确,
故选:ACDE;
(3)已知:①2NH3(g)+CO2(g)═H2NCOONH4(s)△H=-272kJ•mol-1;
②H2NCOONH4(s)═CO(NH2)2(s)+H2O(g)△H=+138kJ•mol-1;
根据盖斯定律,①+②可得:2NH3(g)+CO2(g)?H2O(g)+CO(NH2)2 (s)△H=-134kJ/mol,
故答案为:2NH3(g)+CO2(g)?H2O(g)+CO(NH2)2 (s)△H=-134kJ/mol;
(4)①由图象可知在15分钟左右,氨气和二氧化碳反应生成氨基甲酸铵后不再变化发生的是第1步反应,氨基甲酸铵先增大再减小最后达到平衡,发生的是第二步反应,从曲线斜率不难看出第二步反应速率慢,所以合成尿素总反应的快慢由第二步反应决定,根据图可知,尿素在55分钟时,物质的量不再变化,即反应达到平衡,所以总反应进行到55min时到达平衡,
故答案为:二;55;
②反应进行到10 min时测得CO2的物质的量为0.26mol,二氧化碳的浓度变化为:c(CO2)=$\frac{1mol-0.26mol}{0.5L}$=1.48mol/L,
则用CO2表示的第一步反应的速率v(CO2)=$\frac{1.48mol/L}{10min}$=0.148 mol/(L•min),
故答案为:0.148;
③第2步反应为吸热反应,升高温度平衡向正反应方向移动,平衡常数增大,所以第二步反应的平衡常数K随温度的变化的示意图为 ,
,
故答案为: .
.
点评 本题考查化学平衡计算与影响因素、化学平衡图象、热化学方程式的书写、盐类水解等,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及化学计算能力,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 滴定前,滴定管尖嘴部分有气泡,滴定后气泡消失 | |
| B. | 锥形瓶沾有少量水 | |
| C. | 以甲基橙作指示剂 | |
| D. | 滴定前仰视滴定管读数,滴定后平视刻度读数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 对叔丁基苯酚(
对叔丁基苯酚(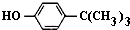 )工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚.实验步骤如下:
)工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚.实验步骤如下: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 起始物质的量浓度(mol/L) | 1.5 | 1 | 0 |
| 2s末物质的量浓度(mol/L) | 0.9 | 0.8 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 名称 | 相对分 子质量 | 性状 | 密度(g/mL) | 沸点(℃) | 溶解性 | |
| 苯胺 | 93 | 无色油状液体 | 1.02 | 184.4 | 微溶于水 | 易溶于乙醇、乙醚 |
| 乙酸 | 60 | 无色液体 | 1.05 | 118.1 | 易溶于水 | 易溶于乙醇、乙醚 |
| 乙酰 苯胺 | 135 | 白色晶体 | 1.22 | 304 | 微溶于冷水,可溶于热水 | 易溶于乙醇、乙醚 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{ω}{5}$ g•mol-1 | B. | 2ωg | C. | 2ω g•mol-1 | D. | 4ω g•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com