
 2NH3(g)ΔH="-92.4" kJ/mol,该反应的能量变化如图所示。
2NH3(g)ΔH="-92.4" kJ/mol,该反应的能量变化如图所示。
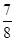 ,此时H2的转化率为 ;欲提高该容器中H2的转化率,下列措施可行的是 (填选项字母)。
,此时H2的转化率为 ;欲提高该容器中H2的转化率,下列措施可行的是 (填选项字母)。| A.向容器中按原比例再充入原料气 |
| B.向容器中再充入一定量H2 |
| C.改变反应的催化剂 |
| D.液化生成物分离出氨 |
 4NH3(g)+3O2(g)
4NH3(g)+3O2(g) H2O(g) ΔH="+44.0" kJ/mol
H2O(g) ΔH="+44.0" kJ/mol 4NH3(g)+3O2(g) ΔH= kJ/mol,该反应的化学平衡常数表达式为K ,控制其他条件不变,增大压强,K值 (填“增大”、“减小”或“不变”)。
4NH3(g)+3O2(g) ΔH= kJ/mol,该反应的化学平衡常数表达式为K ,控制其他条件不变,增大压强,K值 (填“增大”、“减小”或“不变”)。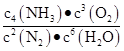 不变
不变 2NH3
2NH3 4NH3(g)+3O2 (g)
4NH3(g)+3O2 (g)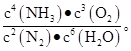 K只受温度的影响,控制其他条件不变,增大压强,K值不变
K只受温度的影响,控制其他条件不变,增大压强,K值不变

科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.熵减的吸热反应可能是自发反应 |
| B.需要加热的化学反应,生成物的总能量一定高于反应物的总能量 |
| C.使用催化剂既不会改变反应的限度又不会改变反应的焓变 |
D.已知2C(s)+2O2(g) 2CO2(g) ΔH1; 2CO2(g) ΔH1; |
 2CO(g) ΔH2,则ΔH1>ΔH2
2CO(g) ΔH2,则ΔH1>ΔH2查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应物能量总和大于生成物能量总和 |
| B.CO(g)+H2(g)=C(s)+H2O(l) ΔH=-131.4 kJ·mol-1 |
| C.水煤气反应中生成1 mol H2(g)吸收131.4 kJ热量 |
| D.水煤气反应中生成1体积CO(g)吸收131.4 kJ热量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.图Ⅰ中ΔH表示某一反应有无催化剂的反应热相同 |
| B.用0.010 0 mol·L-1硝酸银标准溶液,滴定浓度均为0.100 0 mol·L-1 Cl-、Br-及I-的混合溶液,由图Ⅱ曲线,可确定首先沉淀的是Cl- |
| C.图Ⅲ可表示工业合成氨反应在温度一定的情况下反应速率与压强的关系 |
| D.图Ⅳ表示相同体积、相同pH的一元强酸溶液①和一元弱酸溶液②分别与足量的锌粉发生反应,V(H2)随时间的变化曲线 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
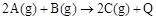 。下列说法或表达正确的是
。下列说法或表达正确的是| A.使用催化剂可改变该反应的反应热 |
B.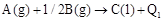 ; ;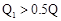 |
C.A和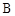 混合气体的稳定性比C气体强 混合气体的稳定性比C气体强 |
| D.该条件下,2LC气体分解成2LA气体与1LB气体吸收的热量为Q |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应物能量总和小于生成物能量总和 |
| B.CO(g)+H2(g)=C(s)+H2O(g) ΔH=+131.4 kJ/mol |
| C.水煤气反应中,生成1 mol H2(g)吸收131.4 kJ热量 |
| D.水煤气反应中生成1体积CO(g)吸收131.4 kJ热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com