
| A. | 431kJ•mol-1 | B. | 649kJ•mol-1 | C. | 896kJ•mol-1 | D. | 946kJ•mol-1 |
分析 根据反应热△H=反应物的总键能-生成物的总键能,然后结合化学反应方程式中各种物质的化学式以及化学计量数进行计算.
解答 解:已知:H-H键能为436kJ•mol-1,N-H键键能为391kJ•mol-1,令N≡N的键能为x,
对于反应N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1.
反应热△H=反应物的总键能-生成物的总键能,故x+3×436kJ•mol-1-2×3×391kJ•mol-1=-92.4kJ•mol-1
解得:x=946kJ•mol-1,
故选D.
点评 本题主要考查反应热的有关计算,为高频考点,侧重于学生的分析能力和计算能力的考查,难度中等,掌握反应热与键能的关系是解题的关键.


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:解答题
| 温度/K | 反应I | 反应II | 已知: K2>K1>K2′>K1′ |
| 298 | K1 | K2 | |
| 398 | K1′ | K2′ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2SO2↑+2H2O | |
| B. | Cu+4NHO3(浓)=Cu(NO3)2+2NO2↑+2H2O | |
| C. | CH2=CH2+Br2→CH2Br-CH2Br | |
| D. | 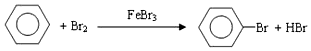 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
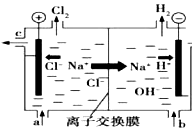 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.完成下列填空:
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.完成下列填空: .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于0.6mol | B. | 等于1mol | ||
| C. | 大于0.6mol小于1mol | D. | 小于0.6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体与溶液本质区别是有无丁达尔效应 | |
| B. | 均一稳定的分散系只有溶液 | |
| C. | 只有胶状物质如胶水、果冻才能称为胶体 | |
| D. | 一束平行光线照射Fe(OH)3胶体时,从侧面可以看到一条光亮通路 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com