
A.SO2 B.Cl2 C.二者皆可 D.二者皆不可
科目:高中化学 来源: 题型:阅读理解
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
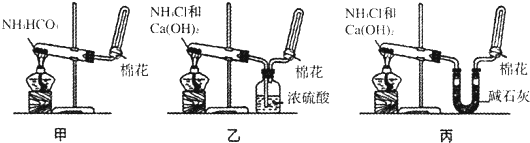
查看答案和解析>>
科目:高中化学 来源: 题型:
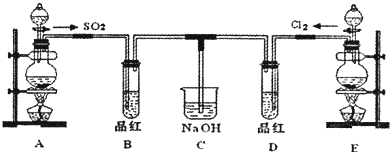
实验一:把SO2和Cl2分别通入品红溶液。
现象:溶液的红色都会立即褪去。
结论:________________________________________。
实验二:把实验一所得的两种无色溶液分别加热。
现象:通入SO2的无色溶液又变红色,而通入Cl2的无色溶液无颜色变化。
结论:________________________________________。
实验三:把SO2和Cl2分别通入放有湿润色布的密闭容器里。
现象:色布都变白,但SO2使色布变白所需时间较长。
结论:________________________________________。
实验四:将SO2和Cl2分别通入石蕊试液中(或使之与湿润的蓝色石蕊试纸接触)。
现象:SO2使之变红,看不到石蕊褪色;Cl2使之变红后立即使之褪色。
结论:________________________________________。
实验五:完成以下三个小题
(1)二氧化硫能使浸过溴水的滤纸褪色,这说明了( )
A.SO2的漂白性 B.溴的挥发性 C.SO2的氧化性 D.溴的氧化性
(2)若在相同状况下,将1体积SO2和1体积Cl2同时通入品红溶液,可观察到品红溶液( )
A.立刻褪色 B.慢慢褪色 C.先褪色,后复原 D.颜色不褪
(3)上述现象的原因是_______________________________________(用离子方程式表示)。怎样用实验来证明发生了该反应?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com