
| A. | 电解时阴极上无金属析出的溶液:Al3+、Zn2+、Cl-、SO42- | |
| B. | 加入铁粉有氢气生成的溶液:Mg2+、K+、NO3- | |
| C. | 通入SO2后无沉淀生成的溶液:Ba2+、Fe3+、Cl-、NO3- | |
| D. | 常温下,水电离出的c(H+)=1×10-12mol/L的溶液中:Cl-、I-、Na+、K+ |
分析 A.电解氢氧化钠溶液时阴极无金属析出,但锌离子、铝离子与氢氧化钠反应;
B.该溶液呈酸性,硝酸根离子在酸性条件下具有强氧化性,与铁反应不会生成氢气;
C.铁离子、酸性条件下的硝酸根离子能够将二氧化硫氧化成硫酸,硫酸与钡离子生成硫酸钡沉淀;
D.该溶液中存在大量氢离子或氢氧根离子,四种离子之间不反应,都不与氢离子、氢氧根离子反应.
解答 解:A.电解时阴极上无金属析出的溶液可以为NaOH溶液,NaOH与Al3+、Zn2+反应,在溶液中不能大量共存,故A错误;
B.加入铁粉有氢气生成的溶液呈酸性,NO3-在酸性条件下与Fe反应不会生成氢气,故B错误;
C.Fe3+能够将SO2氧化成硫酸,NO3-在酸性条件下能够将SO2氧化成硫酸,Ba2+与硫酸反应生成硫酸钡沉淀,不满足条件,故C错误;
D.常温下,水电离出的c(H+)=1×10-12mol/L的溶液呈酸性或碱性,溶液中存在大量氢离子或氢氧根离子,Cl-、I-、Na+、K+之间不反应,都不与氢离子和氢氧根离子反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的正误判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:解答题
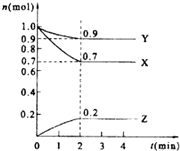 某温度时.在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示.
某温度时.在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯的结构简式:C6H6 | B. | 二氧化碳的电子式: | ||
| C. | KNO3电离方程式:KNO3=K++NO3- | D. | Cl-的结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,20 g D2O分子中所含中子数为10 NA | |
| B. | 0.1 mol FeCl3水解生成的Fe(OH)3胶粒数为0.1 NA | |
| C. | 将lmol Cl2通入水中,HC1O、Cl-、C1O-粒子数之和为2 NA | |
| D. | 常温常压下,11.2 L CO2 与足量Na2O2反应转移的电子数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 泡沫灭火器内分别装有硫酸铝、碳酸钠溶液以及发泡剂 | |
| B. | 明巩既可用做净水剂,也可用作消毒剂 | |
| C. | PM2.5是指直径大于2.5微米的颗粒污染物 | |
| D. | 维生素C具有还原性,可用作食品抗氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
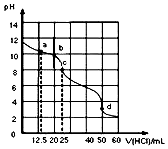 常温下,用0.1000mol•L-1盐酸滴定25mL0.1000mol•L-1Na2CO3溶液,其滴定曲线如图所示,对滴定过程中所得溶液相关离子浓度间的关系,下列有关说法正确的是( )
常温下,用0.1000mol•L-1盐酸滴定25mL0.1000mol•L-1Na2CO3溶液,其滴定曲线如图所示,对滴定过程中所得溶液相关离子浓度间的关系,下列有关说法正确的是( )| A. | a点:c(Cl-)>c(HCO3-)>c(CO32-) | |
| B. | b点:c(Na+)+c(H+)=c(Cl-)+c(HCO3-)+c(CO32-)+c(OH-) | |
| C. | c点:c(CO32-)+c(OH-)=c(H+)+c(H2CO3) | |
| D. | d点:c(Na+)=0.1000mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉长期放置在空气中会被空气中的氧气氧化而变质 | |
| B. | 河水中有许多杂质和有害细菌,加入K2FeO4可以消毒杀菌除杂 | |
| C. | 辽宁舰上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料 | |
| D. | 利用加热的方法杀死人体内感染的埃博拉病毒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com