
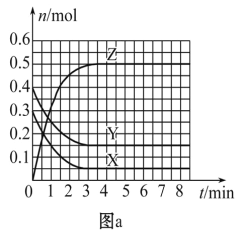
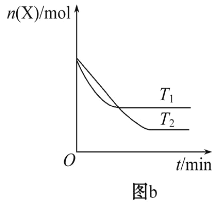
����Ŀ��T0 ��ʱ����2 L���ܱ������з�����Ӧ:X(g)+Y(g)![]() Z(g)(δ��ƽ)�������ʵ����ʵ�����ʱ��仯�Ĺ�ϵ��ͼa��ʾ������������ͬ���¶ȷֱ�ΪT1 �桢T2 ��ʱ������Ӧ��X�����ʵ�����ʱ��仯�Ĺ�ϵ��ͼb��ʾ������������ȷ����
Z(g)(δ��ƽ)�������ʵ����ʵ�����ʱ��仯�Ĺ�ϵ��ͼa��ʾ������������ͬ���¶ȷֱ�ΪT1 �桢T2 ��ʱ������Ӧ��X�����ʵ�����ʱ��仯�Ĺ�ϵ��ͼb��ʾ������������ȷ����
A. �÷�Ӧ������Ӧ�����ȷ�Ӧ
B. T0 �棬�ӷ�Ӧ��ʼ��ƽ��ʱ:v(X)=0. 083 mol��L-1��min-1
C. ͼa�з�Ӧ�ﵽƽ��ʱ��Y��ת����Ϊ37. 5%
D. T1��ʱ�����÷�Ӧ��ƽ�ⳣ��K=50����T1<T0
���𰸡�D
��������
A.���ݡ��ȹ���ƽ��ֵ���ж��¶ȸߵ�,�ٽ��ƽ�����ʵ�����С�жϷ�Ӧ�����͡�
B.����v=c/t ���㡣
C.��ͼa����֪��Y�����ʵ����仯��Ϊ0.25mol,��ʼʱY�����ʵ���Ϊ0.4mol,������ת���ʵĶ�����㡣
D.�ȸ���ͼaȷ����Ӧ����ʽ,�������T0ʱƽ�ⳣ��,�ٽ�������¶�ƽ�������ȷ�Ӧ�ƶ������жϡ�
�÷�Ӧ�ﵽƽ��״̬ʱ,X���ʵ����ı仯��=��0.3-0.05��=0.25mol��Y���ʵ����ı仯��=��0.4-0.15��=0.25mol,Z���ʵ����ĵı仯��=0.5-0=0.5mol�����������ͬ������ʽ�����ʵ�ϵ���ȵ��ڸ����ʵı仯��֮�ȣ����Ը÷�Ӧ�ķ���ʽΪX(g)+Y(g) 2Z(g)��
A.��ͼb����֪��,�¶�ΪT1��ʱ���ȵ���ƽ��,����T1> T2���¶�Խ����ƽ��ʱX�����ʵ���Ũ��Խ��,˵�������¶�ƽ�����淴Ӧ�ƶ�,�����¶�ƽ�������ȷ�Ӧ�ƶ�,������ӦΪ���ȷ�Ӧ,��A������
B. T0 �棬�ӷ�Ӧ��ʼ��ƽ��ʱ:v(X)=��0.3-0.05��/(2��3)=0.042 mol��L-1��min-1, ��B������
C.��ͼa����֪��,Y����ʼ��Ϊ0.4mol��ƽ��ʱY�����ʵ���Ϊ0.15mol��Y�ı仯��Ϊ0.25mol,����Y��ת����Ϊ0.25/0.4��100%=62.5%����C������
D. ��ͼa����֪��,�¶�ΪT0 ���ƽ��ʱ,X��Y��Z�����ʵ���Ũ�ȷֱ�Ϊ0.025mol/L��0.075mol/L��0.25mol/L,��ӦΪX(g)+Y(g) 2Z(g)����ƽ�ⳣ��K=c2(Z)/ c(X)c(Y)=0.25��0.25/(0.075��0.025)=100/3�������Ϸ�����֪���÷�ӦΪ���ȷ�Ӧ��T1��ʱ��K=50��ƽ�ⳣ���������¶ȣ�ƽ�����ƣ���T1<T0����D��ȷ��
��������������ѡD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У���Ϊͬϵ�����
A. CH3CH2CH2CH3��CH��CH3��3 B. ![]()
C. ![]() ��
��![]() D. CH2=CH��CH=CH2��CH2=CHCH3
D. CH2=CH��CH=CH2��CH2=CHCH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ��������ʵ��:
װ�� |
|
|
���� | ������ָ��δ����ƫת | ������ָ�뷢��ƫת |
����˵���в���ȷ����
A. ����Ƭ�������ձ���������ˮ��������ָ��ᷢ��ƫת
B. ��K3[Fe(CN)3]��Һ������Ƭ��������Һ�����жϵ�ص���������
C. ��Ƭ��ĸ�ʴ���ʲ����
D. ��������ָ��δ����ƫת������Ƭ����Ƭ���δ����ʴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������ȷ����
A. 2NO2(g)(����ɫ)![]() N2O4(g)(��ɫ)����H<0����ƽ���ƽ����ϵ��ȡ��С�ݻ�������ѹǿ�Ĵ�ʩ����Ϊƽ��������Ӧ�����ƶ�������ϵ��ɫ��dz
N2O4(g)(��ɫ)����H<0����ƽ���ƽ����ϵ��ȡ��С�ݻ�������ѹǿ�Ĵ�ʩ����Ϊƽ��������Ӧ�����ƶ�������ϵ��ɫ��dz
B. ����C(s) + O2(g) ![]() 2CO(g) ����ƽ�����̼��ƽ��������Ӧ�����ƶ�
2CO(g) ����ƽ�����̼��ƽ��������Ӧ�����ƶ�
C. FeCl3+3KSCN![]() Fe(SCN)3(��ɫ)+3KCl����ƽ�������KCl����Ϊƽ�����淴Ӧ�����ƶ�������ϵ��ɫ��dz
Fe(SCN)3(��ɫ)+3KCl����ƽ�������KCl����Ϊƽ�����淴Ӧ�����ƶ�������ϵ��ɫ��dz
D. ����N2+3H2![]() 2NH3��ƽ���ѹǿ���䣬����O2��ƽ�����淽���ƶ�
2NH3��ƽ���ѹǿ���䣬����O2��ƽ�����淽���ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�����ֵ�����й�������ȷ����
A. ���³�ѹ��, 30 g�����������ļ��Թ��ۼ���Ϊ6NA
B. 0.1mol Fe���������ᷴӦ��ת�Ƶĵ�����Ϊ0.3NA
C. 0.1 mol![]() Srԭ���к�������Ϊ3.8NA
Srԭ���к�������Ϊ3.8NA
D. 0.1mol��L��1��NH4NO3��Һ�к��еĵ�ԭ����Ϊ0.2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ�״���£���22.4LHCl��ȫ����1Lˮ�У�ˮ���ܶȽ���Ϊ1g/mL������Һ���ܶ�Ϊ��g/cm3������1������Һ�����ΪVmL�����ʵ���������Ϊw�����ʵ����ʵ���Ũ��Ϊc mol/L��������������ȷ���ǣ� ��
��w=![]() ��100% ��c=1molL��1 ����������Һ���ټ���VmLˮ��������Һ��������������0.5w����������Һ���ټ���VmLˮ��������Һ����������С��0.5w
��100% ��c=1molL��1 ����������Һ���ټ���VmLˮ��������Һ��������������0.5w����������Һ���ټ���VmLˮ��������Һ����������С��0.5w
A. �٢ڢ�B. �٢ۢ�C. �٢�D. �٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2AΪ��Ԫ���ᡣ20��ʱ������һ��c(H2A)+c(HA��)+c(A2��)��0.100molL��1��H2A��NaOH�Ļ����Һ����Һ�в����������ʵ���Ũ����pH�ı仯��������ͼ��ʾ������ָ����Һ���������ʵ���Ũ�ȹ�ϵһ����ȷ����(����)

A. H2A��Ka1��10��1.2
B. pH��4.2����Һ�У�c(HA��)��c(A2��)��0.050 molL��1
C. pH��7����Һ�У�c(Na+)��2c(A2��)+c(H+)
D. c(Na+)��0.150 molL��1����Һ�У�2c(OH��)+c(HA��)+3c(H2A)��2c(H+)+c(A2��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ��Ӧ���ͷ�����ԭ�Ӿ��������ǣ� ��
A.�û���ӦB.ȡ����ӦC.�ֽⷴӦD.�Ӿ۷�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijЩ�������Ϻ��з�����Ԫ���22286Rn������������һ��Σ�����о�����뱵��������°���WHO�϶���19���°������У��Ϊ����֮һ�����������̡���ԭ�ӵ���������������֮�ͼ�֮��ֱ���
A. 136��86B. 50��136
C. 222 �� 50D. 222��86
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com