
分析 (1)根据能电离出醋酸根离子和钠离子的物质的组合情况来回答;
(2)根据质子守恒分析解答;
(3)分别根据醋酸钠溶液中的电荷守恒和物料守恒计算;
(3)溶液中存在电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以c(Na+)-c(CH3COO-)=c(OH-)-c(H+)=$\frac{1{0}^{-14}}{1{0}^{-8}}$mol/L-10-8 mol/L=(10-6-10-8)mol/L;
(4)A.等浓度的CH3COONa和醋酸混合溶液中,醋酸的电离程度大于醋酸根离子的水解程度;
B.醋酸钠溶液中,钠离子浓度大于醋酸根浓度;
C.由0.2mol/L的CH3COONa溶液与0.1mol/L的HCl溶液等体积混合而成,得到物质的量浓度相等的醋酸、醋酸钠和氯化钠;
D.由0.2mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合而成,得到等物质的量浓度的醋酸和醋酸钠;
(5)常温下,将a mol/L的CH3COOH溶液与0.01mol/L的NaOH溶液等体积混合,反应平衡后溶液中c(Na+)=c(CH3COO-),根据电荷守恒得c(OH-)=c(H+),溶液呈中性,电离平衡常数Ka=$\frac{c(C{H}_{3}CO{O}^{-})c({H}^{+})}{c(C{H}_{3}COOH)}$,以此计算
解答 解:(1)能电离出醋酸根离子的物质可以是醋酸和醋酸钠,能电离出钠离子的物质可以是氢氧化钠和醋酸钠,所以当溶液中含有Na+和CH3COO-在以及OH-、H+时,溶液中溶质的组成可以是:①CH3COONa、CH3COONa和CH3COOH、CH3COONa和NaOH,故答案为:CH3COONa;CH3COONa和CH3COOH;CH3COONa和NaOH;
(2)25℃,若由0.1mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合,测得混合溶液的pH=8,由质子守恒可知:c(CH3COOH)+c(H+)=c(OH-)=1×10-6,故答案为:1×10-6;
(3)溶液中存在电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以c(Na+)-c(CH3COO-)=c(OH-)-c(H+)=$\frac{1{0}^{-14}}{1{0}^{-8}}$mol/L-10-8 mol/L=(10-6-10-8)mol/L=9.9×10-7,
故答案为:9.9×10-7;
(4)A.等浓度的CH3COONa和醋酸混合溶液中,醋酸的电离程度大于醋酸根离子的水解程度,所以离子的浓度大小为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故符合;
B.醋酸钠溶液中,钠离子浓度大于醋酸根浓度,故不符合;
C.由0.2mol/L的CH3COONa溶液与0.1mol/L的HCl溶液等体积混合而成,得到物质的量浓度相等的醋酸、醋酸钠和氯化钠,钠离子浓度大于醋酸根浓度,故不符合;
D.由0.2mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合而成,得到等物质的量浓度的醋酸和醋酸钠,醋酸的电离程度大于醋酸根离子的水解程度,所以离子的浓度大小为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故符合;
故选:AD;
(5)常温下,将a mol/L的CH3COOH溶液与0.01mol/L的NaOH溶液等体积混合,反应平衡后溶液中c(Na+)=c(CH3COO-),根据电荷守恒得c(OH-)=c(H+),溶液呈中性,又电离平衡常数Ka=$\frac{c(C{H}_{3}CO{O}^{-})c({H}^{+})}{c(C{H}_{3}COOH)}$,c(H+)=10-7mol/L,c(Na+)=c(CH3COO-)=0.005mol/L,c(CH3COOH)=$\frac{a}{2}$mol/L,则Ka=$\frac{1{0}^{-9}}{a-0.01}$,故答案为:$\frac{1{0}^{-9}}{a-0.01}$.
点评 本题考查离子浓度的大小比较以及弱电解质的电离等问题,题目难度较大,注意根据溶液离子浓度的关系结合弱电解质的电离和盐类的水解等知识解答.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 氧化铜与稀盐酸反应 O2-+2H+═H2O | |
| B. | 向碳酸氢钠溶液中滴加稀盐酸:HCO3-+H+═H2O+CO2↑ | |
| C. | 氢氧化钡溶液和稀硫酸反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 向澄清石灰水中通入少量CO2:CO2+OH-═HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (写结构简式).
(写结构简式).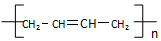 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式为CH2CH2 | B. | 氢氧根的电子式: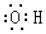 | ||
| C. | Ca2+的结构示意图为  | D. | 溴乙烷的分子式:CH3CH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{22.4pb}{a{N}_{A}}$ | B. | $\frac{22.4ab}{p{N}_{A}}$ | C. | 22.4NAba | D. | $\frac{22.4ap}{b{N}_{A}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将58.5 g NaCl溶解于1 L 水中 | |
| B. | 将22.4 L氨气溶于水配成1 L溶液 | |
| C. | 将1 L 10 mol•L-1的浓盐酸与9 L水混合 | |
| D. | 将10 g NaOH溶解在水中配成250 mL溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 检验氨气时,需用玻璃棒沾取湿润的红色石蕊试纸靠近导管口 | |
| C. | 用稀硝酸溶液洗涤并灼烧铂丝后,再进行焰色反应 | |
| D. | 用CCl4萃取溴水中的溴,分液时有机层从分液漏斗的上口倒出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com