
【题目】工业上除去电石渣浆(含CaO)上清液中的S2-,并制取石膏( CaSO42H2O)的常用流程如下:
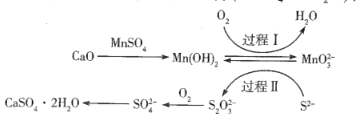
下列说法正确的是
A.Mn(OH)2、MnO32-在过程I、II中均起催化剂作用
B.过程I中,反应的离子方程式为2Mn(OH)2 +O2 +4OH-=2MnO32- +4H2O
C.将10L上清液中的S2 -转化为SO42-(S2-浓度为480 mg·L-1),理论上共需要0.03mol的O2
D.常温下,56 g CaO溶于水配成1 L溶液,溶液中Ca2+的数目为6.02 ×1023个
【答案】B
【解析】
A. Mn(OH)2在过程I化合价升高,作还原剂,MnO32在过程II中化合价降低,作氧化剂,故A错误;
B. 过程I中,根据化合价升降守恒得到反应的离子方程式为2Mn(OH)2 +O2 +4OH-= 2MnO32 +4H2O,故B正确;
C. 将10L上清液中的S2转化为SO42 (S2浓度为480 mg·L-1),质量为480 mg·L1×10L = 4800mg=4.8g,物质的量为![]() ,根据得失电子守恒0.15mol×8=n(O2)×4,n(O2) =0.3mol,理论上共需要0.3mol的O2,故C错误;
,根据得失电子守恒0.15mol×8=n(O2)×4,n(O2) =0.3mol,理论上共需要0.3mol的O2,故C错误;
D. 常温下,饱和石灰水的物质的量浓度为0.002 molL1,因此56 g CaO溶于水配成1 L溶液,是饱和溶液,因此1L溶液中Ca2+的数目为0.002NA个,故D错误。
综上所述,答案为B。


科目:高中化学 来源: 题型:
【题目】反应:xA(气)+yB(气)![]() zC(气),达到平衡时测得A气体的浓度为0.5 mol.L-1,当在恒温下将该容器体积扩大一倍,再次达到平衡,测得A气体的浓度为0.3 mol.L-1,则下列叙述正确的是
zC(气),达到平衡时测得A气体的浓度为0.5 mol.L-1,当在恒温下将该容器体积扩大一倍,再次达到平衡,测得A气体的浓度为0.3 mol.L-1,则下列叙述正确的是
A. x+y<z B. 平衡向右移动
C. B的转化率升高 D. C的体积分数降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在80 ℃时,将0.40 mol的N2O4气体充入2 L真空的固定容积的密闭容器中,发生反应:N2O4 ![]() 2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
n(N2O4) /mol | 0.40 | 0.28 | 0.20 | 0.14 | 0.10 | 0.10 |
n(NO2) /mol | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)计算20~40 s内用N2O4表示的平均反应速率为__________。
(2)40s时,NO2的的浓度b=_________mol/L,反应最迟到________s到达平衡状态
(3)反应进行至100 s后将反应混合物的温度降低,混合气体的颜色________(填“变浅”“变深”或“不变”)。
(4)要增大该反应的K值,可采取的措施有___________(填序号)。
A. 增大N2O4的起始浓度 B. 向混合气体中通入NO2
C. 使用高效催化剂 D. 升高温度
(5)能说明该反应达到平衡状态的标志是_________(填序号)
A. 2 v(N2O4 ) =v(NO2 ) B. 容器内压强保持不变
C. 容器内密度保持不变 D. NO2的体积分数保持不变
(6)如图是80 ℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60 ℃时N2O4物质的量的变化曲线______。
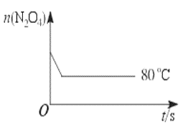
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】侯氏制碱法制备碳酸氢钠的原理为NH3+H2O+CO2 +NaCl=NH4Cl+NaHCO3↓,某化学小组用如图装置在实验室中模拟该制备过程,下列说法不正确的是
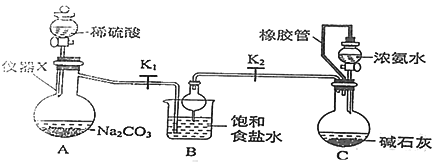
A. 装置A中仪器X的名称为蒸馏烧瓶
B. 装置B中球形干燥管的作用是防止倒吸
C. 装置C中橡胶管的作用是平衡压强,使溶液顺利滴下
D. 实验开始后,应先打开K1一段时间,然后再打开K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液中还可能存在Al3+、Fe2+、NH4+、Ba2+、Cl-、CO32-、SO42-、NO3-中的若干种,现取适量溶液进行如下一系列实验
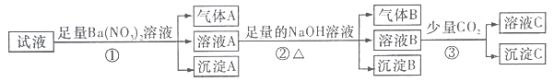
下列有关判断正确的是( )
A. 原试液中一定有Fe2+、SO42-、H+、NH4+、Al3+
B. 原试液中一定没有Ba2+、CO32-、NO3-
C. 步骤③中发生反应的离子方程式为: 2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
D. 沉淀B在空气中由白色迅速变成灰绿色,最终变为红褐色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究化学反应速率和化学反应限度的有关问题,某研究小组进行了以下实验:
实验一:为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表。
(已知I2+2S2O![]() ==S4O
==S4O![]() +2I- ,其中Na2S2O3溶液均足量,且S2O
+2I- ,其中Na2S2O3溶液均足量,且S2O![]() 与S4O
与S4O![]() 均为无色)
均为无色)
实验序号 | 体积V/mL | 蓝色褪去时间/s | |||
Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
(1)表中Vx=_________mL,t1、t2、t3的大小关系是___________________
实验二:取5 mL 0.1 mol·L-1的KI溶液于试管中,滴加0.1 mol·L-1 FeCl3溶液2 mL,发生如下反应:2Fe3++2I-=2Fe2+ +I2,为证明该反应存在一定的限度,他们设计了如下实验:
①取少量反应液,滴加AgNO3溶液,发现有少量黄色沉淀(AgI)。
②再取少量反应液,滴加少量CCl4 ,振荡,发现CCl4层显浅紫色。
根据①②的现象,/span>他们得出结论:该反应具有一定的可逆性,在一定条件下会达到反应限度。
(2)指导老师指出上述实验①不合理,其原因是_______________ ; 你的改进方案是________(简要写出操作、试剂和现象)。
(3)实验②适合检验生成I2较多的情况,还有一种简便的方法可以灵敏地检验是否生成了I2,这种方法所用的试剂是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炒过菜的铁锅未及时洗净(残液中含NaCl),不久便会因被腐蚀而出现红褐色锈斑。腐蚀原理如右图所示,下列说法正确的是
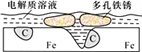
A. 腐蚀过程中,负极是C
B. Fe失去电子经电解质溶液转移给C
C. 正极的电极反应式为4OH―-4e-==2H2O+O2↑
D. 每生成1mol铁锈(Fe2O3·xH2O)理论上消耗标准状况下的O233.6L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科研人员研制出透氧膜,它允许e-和O2-同时通过,可实现水连续分解制备氢气,工作时CO、H2O分别在透氧膜的两侧反应。工作原理如图所示,下列说法正确的是

A.CO在a侧上反应
B.b侧的反应式:H2O+2e- = H2↑+ O2-
C.该透氧膜可实现太阳能向氢能的转化
D.当有2mol电子通过透氧膜时,就会消耗22.4L CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物是生命产生的物质基础,其种类繁多。下列各组物质:①![]() 与
与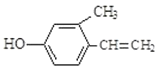 ②CH3CH2CH2CHO与CH3COCH2CH3;③淀粉和纤维素;④正戊烷和2-甲基丁烷;⑤
②CH3CH2CH2CHO与CH3COCH2CH3;③淀粉和纤维素;④正戊烷和2-甲基丁烷;⑤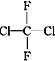 和
和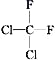 ;⑥
;⑥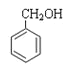 和
和![]() ;⑦2-甲基-1,3-丁二烯和1,3-丁二烯
;⑦2-甲基-1,3-丁二烯和1,3-丁二烯
(1)互为同系物的是_________________;(填序号,下同);互为同分异构体的是____________;
(2)物质![]() 的含氧官能团名称为_______________;
的含氧官能团名称为_______________;
(3)某单烯烃与足量氢气反应后能生成2-甲基丁烷,已知该烯烃分子中含有 3 个甲基,该烯烃的系统命名为______________;该烯烃在催化剂作用下,发生加聚反应产生高分子物质的化学方程式为_____________;
(4)某烃为正戊烷的同系物,其相对分子质量为114,其一氯代物只有一种,该烃的系统命名为_________。
(5)已知烯烃能够被臭氧氧化,其过程为:![]() ,若将②中两化合物看作是某单烯烃被臭氧氧化生成的,则该单烯烃的结构简式为_________________________。
,若将②中两化合物看作是某单烯烃被臭氧氧化生成的,则该单烯烃的结构简式为_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com