
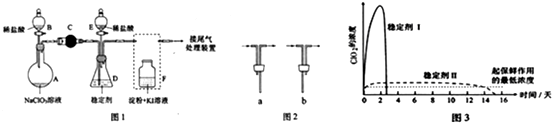
分析 (1)根据仪器特征,可知仪器C是干燥管;F装置应是Cl2和KI反应,还需要连接尾气处理装置,所以应长管进气,短管出气;
(2)在2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O反应中,NaClO3中氯元素化合价由+5价降低为+4价,NaClO3是氧化剂,还原产物是ClO2;HCl中氯元素化合价由-1价升高为0价,HCl是还原剂,氧化产物是Cl2,根据产物可知起还原剂与酸性的氯化氢各占一半;为使ClO2在D中被稳定剂充分吸收,产生ClO2的速率要慢;
(3)氯气有毒,能够与碘化钾反应,被碘化钾溶液吸收;
(4)在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,根据元素守恒可知应还有水生成,据此分析书写离子方程式; 在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是验证是否有ClO2 生成;
(5)由图可知,稳定剂Ⅱ可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度.
解答 解:(1)仪器C具有球形特征,据此可知该仪器是干燥管;F装置应是Cl2和KI反应,还需要连接尾气处理装置,所以应长管进气,短管出气,故选b,
故答案为:干燥管;b;
(2)在氧化还原反应中,反应物中元素化合价降低的物质为氧化剂,化合价升高的物质为还原剂,2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O反应中,NaClO3中氯元素化合价由+5价降低为+4价,NaClO3是氧化剂,还原产物是ClO2;HCl中氯元素化合价由-1价升高为0价,HCl是还原剂,氧化产物是Cl2,根据氧化产物是Cl2,可知起还原剂与酸性的氯化氢各占一半,所以该反应中氧化剂与还原剂物质的量之比为1:1,为使ClO2在D中被稳定剂充分吸收,产生ClO2的速率要慢,
故答案为:1:1;慢;
(3)氯气有毒,能够与碘化钾反应,被碘化钾溶液吸收,所以F的作用为吸收Cl2,
故答案为:吸收Cl2;
(4)在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,根据元素守恒可知应还有水生成,该反应的离子方程式为:4H++5ClO2-=Cl-+4ClO2↑+2H2O; 在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是验证是否有ClO2 生成,
故答案为:4H++5ClO2-=Cl-+4ClO2↑+2H2O;验证是否有ClO2 生成;
(5)由图可知,稳定剂Ⅱ可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度,所以稳定剂Ⅱ好,
故答案为:稳定剂Ⅱ;稳定剂Ⅱ可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度.
点评 本题以ClO2的制备、吸收、释放为载体,考查实验制备方案设计、基本操作、对装置及操作的分析评价等,注意根据问题进行制备流程分析,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:选择题
| A. | NH3、O2、NO2 | B. | N2、O2、H2 | C. | NO、O2、NH3 | D. | HBr、NH3、Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.6g由NO2与N2O4组成的混合物中含有的N原子数为0.1NA | |
| B. | 40mL 10mol/L的浓HNO3与足量的Cu反应产生NO2分子数为0.2NA | |
| C. | 标准状况下,6.72LSO3中,含有的原子数目为0.3NA | |
| D. | 1L 0.1mol/L的氨水中含有的NH4+数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 给盛有液体的烧瓶加热时,需要加碎瓷片或沸石 | |
| B. | NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热 | |
| C. | 不慎将少量浓硫酸溅到皮肤上,应立即用水冲洗,然后涂抹10%的NaOH溶液 | |
| D. | 中和滴定实验时,不必润洗锥形瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3OH | B. | C2H5OH | C. | HO-CH2CH2-OH | D. | CH3CH2CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫的还原性 | B. | 硫的漂白性 | ||
| C. | 二氧化硫的还原性 | D. | 二氧化硫的漂白性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com