
| A. | 元素X:位于元素周期表中的第三周期ⅢA 族 | |
| B. | 元素Y:它的二价阳离子核外电子总数与氖原子相同 | |
| C. | 元素Z:它的原子中M层比L层少2个电子 | |
| D. | 元素W:它的化合物的焰色反应颜色呈黄色 |
分析 既能与盐酸反应生成盐和水,又能与NaOH溶液反应生成盐和水的氧化物是两性氧化物,在短周期元素中,只有氧化铝属于两性氧化物;
A.X位于周期表中第三周期第IIIA族,为Al元素;
B.Y的二价阳离子核外电子总数与Ne原子相同,则Y原子核外电子数为12,为Mg元素;
C.Z的原子中M层比L层少2个电子,为S元素;
D.W的化合物焰色反应呈黄色,为Na元素.
解答 解:既能与盐酸反应生成盐和水,又能与NaOH溶液反应生成盐和水的氧化物是两性氧化物,在短周期元素中,只有氧化铝属于两性氧化物;
A.X位于周期表中第三周期第IIIA族,为Al元素,Al的氧化物属于两性氧化物,符合题意,故A正确;
B.Y的二价阳离子核外电子总数与Ne原子相同,则Y原子核外电子数为12,为Mg元素,MgO为碱性氧化物,能和酸反应但和碱不反应,故B错误;
C.Z的原子中M层比L层少2个电子,为S元素,其氧化物为酸性氧化物,能和碱反应但和酸不反应,故C错误;
D.W的化合物焰色反应呈黄色,为Na元素,其氧化物为碱性氧化物,能和酸反应但和碱不反应,故D错误;
故选A.
点评 本题考查元素周期表和元素化合物性质,为高频考点,正确判断元素是解本题关键,知道酸性氧化物、碱性氧化物、两性氧化物的基本概念,题目难度不大.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 采取低碳、节俭的生活方式 | B. | 按规定对生活废弃物进行分类放置 | ||
| C. | 经常使用一次性筷子、塑料袋 | D. | 深入农村和社区,加强环保宣传 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
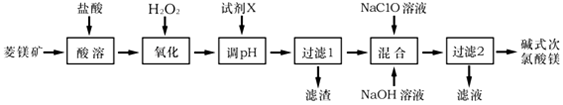
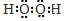 ,它的作用是将Fe2+氧化为Fe3+.
,它的作用是将Fe2+氧化为Fe3+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | Na2O2中既含有离子键又含有非极性共价键 | |
| C. | KOH中只含有共价键 | |
| D. | KI和HI中化学键类型完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ③④⑤⑥ | C. | ①③⑤⑥ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
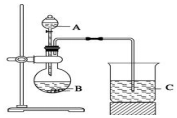 一组同学设计了如图装置来一次性完成验证C、Si、S非金属性强弱的实验
一组同学设计了如图装置来一次性完成验证C、Si、S非金属性强弱的实验查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
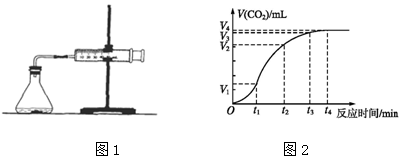
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com