
四种短周期元素X、Y、Z、W,原子序数依次增大,请结合表中信息回答下列问题。
(1)W元素在周期表的位置为______________。
(2)上述元素的最高价氧化物对应的水化物中,有一种物质与其它三种物质在一定条件下均能发生化学反应,该元素是_________(填元素名称)。
(3)X元素的最高价氧化物对应的水化物与其气态氢化物反应得到的化合物为___________(填化学式)。
(4)向含有Z元素的简单阳离子的溶液中加入过量的NaOH溶液,发生反应的离子方程式为_____________________________________。
(5)下列可作为比较Z和Mg金属性强弱的方法是_______(填代号)。
a.测两种元素单质的硬度和熔、沸点
b.测等浓度相应氯化物水溶液的pH
c.比较单质与同浓度盐酸反应的剧烈程度
d.比较两种元素在化合物中化合价的高低
(6)Z单质和Mg组成的混合物是一种常见的焰火材料,某化学兴趣小组设计了如下图所示的实验方案,测定该混合物中Z的质量分数。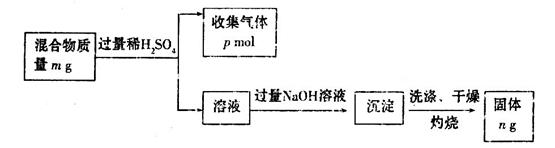
能确定混合物中Z的质量分数的数据组有_________(填代号)。
a.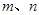 b.
b.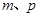 c.
c.
(1)第三周期 第ⅣA族(2分)
(2)钠(2分)
(3)NH4NO3 (2分)
(4)Al3++4OH-=[Al(OH)4]- (2分)
(5)bc (2分)
(6)abc (2分)
解析试题分析:由表中信息可得X为N,Y为Na,Z为Al,W为Si。
(1)Si在元素周期表的位置为第三周期 第ⅣA族。
(2)氢氧化钠可以和硝酸、氢氧化铝、硅酸均可以反应。
(3)氨气和硝酸反应:NH3++HNO3=NH4NO3.
(4)略
(5)金属性强弱的方法有:比较最高价氧化物对应水化物的碱性强弱,比较置换出氢的难易程度,另外比较等浓度相应氯化物水溶液的pH也可以,pH越小,金属性越弱。
(6)a.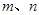 w =1-(3n)/(5m)
w =1-(3n)/(5m)
b.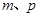 设Al的物质的量为x,Mg的物质的量为y,则y+3x/2=p,27x+24y=m,可解得x,y。就可以求出Z的质量分数。
设Al的物质的量为x,Mg的物质的量为y,则y+3x/2=p,27x+24y=m,可解得x,y。就可以求出Z的质量分数。
c. 设Al的物质的量为x,Mg的物质的量为y,y+3x/2=p,40y=n。可解得x,y。就可以求出Z的质量分数
设Al的物质的量为x,Mg的物质的量为y,y+3x/2=p,40y=n。可解得x,y。就可以求出Z的质量分数
考点:元素周期律和元素周期表


科目:高中化学 来源: 题型:填空题
氢气是一种清洁能源,氢气的制取与储存是氢气能源利用领域的研究热点。
已知:CH4(g)+H2O(g)=CO(g)+3H2(g)ΔH =+206.2 kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g)ΔH =+247.4 kJ·mol-1
2H2S(g)=2H2(g)+S2(g)ΔH =+169.8 kJ·mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与 H2O(g)反应生成CO2(g)和 H2(g)的热化学方程式为_________________________
(2)H2S 热分解制氢时,常向反应器中通入一定比例空气,使部分 H2S 燃烧,其目的是________;燃烧生成的 SO2与 H2S 进一步反应,生成物在常温下均为非气体,写出该反应的化学方程式:___________________________
(3)H2O 的热分解也可得到 H2,高温下水分解体系中主要气体的体积分数与温度的关系如图甲所示。图中 A、B 表示的物质依次是______________________________________。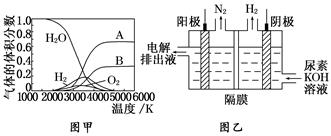
(4)电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图见图乙(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为_____________________
(5)Mg2Cu 是一种储氢合金。 350 ℃时,Mg2Cu 与 H2反应,生成 MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为 0.077)。Mg2Cu 与 H2反应的化学方程式为_____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
写出下列除去杂质所用的试剂和对应的离子方程式:
(1)FeCl2溶液混有FeCl3杂质,除杂试剂___________,离子方程式_________________________ 。
(2)CO2气体混有HCl杂质,除杂试剂_____________,离子方程式____________________________。
(3)NaHCO3溶液混有Na2CO3杂质,除杂试剂________,离子方程式___________________________。
(4)NO中混有NO2杂质,除杂试剂_____________,离子方程式_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某同学设计如图装置,研究非金属元素性质变化规律.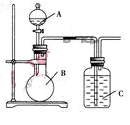
(1)已知硅酸(H2SiO3)是一种难溶于水的弱酸,呈白色。在化学反应中,一般地,强酸能制弱酸,如NaHCO3+HCl=NaCl+CO2↑+H2O,得出:HCl酸性强于H2CO3的酸性。现有硝酸溶液、碳酸钙、澄清石灰水、硅酸钠溶液,选择试剂用如图装置证明:酸性:HNO3>H2CO3>H2SiO3。
A中装试剂________,B中装试剂____________,C中装试剂____________。C中实验现象为____________;写出C中发生反应的离子方程式_____________________________。
(2)已知高锰酸钾在常温下与浓盐酸反应产生氯气,利用如图装置证明氯气氧化性强于碘单质的氧化性。则A中装浓盐酸,B中装入高锰酸钾粉末,C中装试剂________,C中现象________,写出离子方程式__________________。该实验装置有明显不足,请指出改进方法:_______________________________________。
(3)如果C中装饱和的氢硫酸溶液,A中装浓盐酸,B中装高锰酸钾溶液,反应开始后观察到现象是C中产生淡黄色沉淀,写出化学方程式______________________________;证明氯的非金属性比硫的非金属性________(填“强”或“弱”或“无法判断”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、W是元素周期表前四周期的常见元素,其相关信息如下表:
| X | X的一种核素的质子数为56,中子数为30 |
| Y | 海水中元素含量最高的金属元素 |
| Z | 常温常压下,Z单质是淡黄色固体,常在火山口附近沉积 |
| W | 价电子的排布式为3s23p3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业。
(1)工业上可用氯化钠为原料,通过电解的方法制得NaClO,工业上制取NaClO的离子反应方程式为
电解后的溶液PH 7(填大于、小于、等于);其原因是 (用离子方程式表示)
(2)KAl(SO4)2溶液中质子守恒等式为
(3)某小组同学用下图所示装置探究饱和NaClO和KAl(SO4)2溶液混合反应的实验。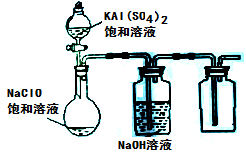
①打开活塞向烧瓶中加入饱和KAl(SO4)2溶液,产生大量的白色胶状沉淀。此时反应的离子方程式为
。
②将烧瓶中的混合液在阳光照射下,不久烧瓶中有黄绿色气体产生,充分反应后集气瓶中收集到一种无色无味的气体。写出在光照射下混合液中反应的化学方程式是 。
(4)若将分液漏斗中的KAl(SO4)2溶液换成硫酸亚铁铵(一种复盐:(NH4)2SO4·FeSO4)溶液,其他不变。打开分液漏斗活塞向烧瓶中滴入足量的硫酸亚铁铵溶液。观察到烧瓶中有红褐色沉淀产生,但是没有观察到黄绿色气体产生。此时烧瓶中发生的氧化还原反应的离子方程式为
。
(5)取100mL 0.1mol/L Ba(OH)2溶液,向其中逐滴加入同浓度的KHSO4溶液至Ba2+恰好完全沉淀,此时溶液的PH值为 (忽略两溶液混合时的体积变化,混合后溶液的温度为100℃,100℃时Kw=1x10-12)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
将晶体X加热分解,可得A、B、D、E、F和水六种产物,其中A、B、D都是中学化学中常见的氧化物,气体E是单质F所含元素的氢化物。
(1)A能溶于强酸、强碱,写出A与强碱溶液反应的离子方程式_______________。
(2)B、D都是酸性氧化物且组成元素相同,D溶于水得强酸,则B、D分子中除氧元素外所含另一种元素在周期表中的位置是_______________。
(3)E能使湿润的红色石蕊试纸变蓝,实验室制取E气体的化学方程式为________________,制得的气体可用如图所示装置收集,则气体应从_______(填“A”或“B”)通入。
(4)由各分解产物的物质的量之比推测X的组成类似于明矾,则其化学式为___________,若向X的浓溶液中滴加浓NaOH溶液至过量,现象依次为_______________ 、___________ _、
_____________ 。
(5)取一定量的X晶体分解,若生成F 1 mol,则必同时生成_______ 物质_____ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
abcd是四种短周期元素。a、b、d同周期,c、d同主族.a原子结构示意图 ,b与c形成化合物的电子式为如图
,b与c形成化合物的电子式为如图 。下列比较中正确的是
。下列比较中正确的是
| A.原子半径:a >c>d | B.非金属性:a >b>d |
| C.单质的熔点:c> a | D.最高价氧化物对应的水化物的酸性:c>d>a |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中,常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液。下列说法不正确的是
| A.原子半径的大小顺序为W>Q>Z>X>Y |
| B.元素X的气态氢化物与Q的单质可发生置换反应 |
| C.元素X与Y可以形成5种以上的化合物 |
| D.元素Q的最高价氧化物对应的水化物酸性比W的强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com