
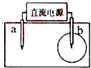
 取一张用饱和的NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现b电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色.则下列说法错误的是( )
取一张用饱和的NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现b电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色.则下列说法错误的是( )| A、a电极是阴极 |
| B、电解过程中水是氧化剂 |
| C、a电极附近溶液的pH变小 |
| D、b极电极反应式为:2Cl--2e-═Cl2↑ |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、该反应属于熵增放热反应,一定能自发进行 |
| B、5 min内H2的平均反应速率为0.1 mol/(L?min) |
| C、其它条件不变的情况下,加入催化剂可提高CO的转化率 |
| D、若该温度下,反应物的起始浓度c(CO)=4 mol/L,c(H2)=a mol/L,达到平衡后,c(CH3OH)=2 mol/L,则a=5.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 试剂 | 物质 | 试剂 |
| CuO(Al2O3) | FeCl3溶液(FeCl2) | ||
| NaHCO3溶液(Na2CO3) | Fe(Al) | ||
| C02(HCl) | Cu(Zn) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、O2和H2的混合气体 |
| B、0.05molH2 |
| C、大于0.05molH2 |
| D、小于0.05molH2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 L 1 mol?L-1的FeCl3溶液中含有NA个Fe3+ |
| B、标准状况下,22.4 L己烷中共价键数目为19NA |
| C、由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA |
| D、常温常压下的33.6 L氯气与27 g铝反应,转移电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化性 | B、还原性 |
| C、碱性 | D、酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
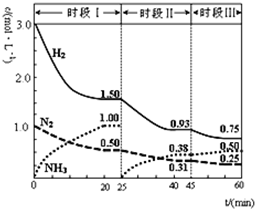 N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ?mol-1.恒容时,体系中各物质浓度随时间变化的曲线如图示.下列说法正确的是( )
N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ?mol-1.恒容时,体系中各物质浓度随时间变化的曲线如图示.下列说法正确的是( )| A、前20分钟反应内放出的热量为46.2kJ |
| B、第25分钟改变的条件是将NH3从反应体系中分离出去 |
| C、若第60分钟时反应又达到了平衡,则时段Ⅲ改变的条件是增大压强 |
| D、时段Ⅰ仅将初始投放的物质浓度增至原来的2倍,则反应物的转化率增大,平衡常数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO和N2 |
| B、O3和SO2 |
| C、CO2和N2O |
| D、N2H4 和C2H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol I2(g)中通入2gH2(g),反应放热9.48 kJ |
| B、1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ |
| C、反应(i)的产物比反应(ii)的产物稳定 |
| D、反应(ii)的反应物总能量比反应(i)的反应物总能量低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com