
【题目】下列电离方程式中正确的( )
A. NaHSO4Na++H++SO42-
B. NaHCO3═Na++H++CO32-
C. HClO ═ H++ClO-
D. H2S H++HS- , HS- H++S2-
科目:高中化学 来源: 题型:
【题目】下列离子在溶液中能大量共存的是( )
A. Na+、CO32-、SO42-、H+ B. K+、AlO2-、H+、Cl-
C. Fe2+、K+、OH-、NO3- D. Al3+、H+、NO3-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积均为1L的三个密闭容器中,分别放入铁粉并充入1mo1CO ,控制在不同温度下发生反应:![]() 当反应进行到5min时,测得CO的体积分数与温度的关系如图所示。下列说法一定正确的是
当反应进行到5min时,测得CO的体积分数与温度的关系如图所示。下列说法一定正确的是
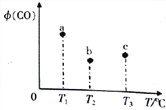
A. 反应进行到5min时,b容器中v(正)=v(逆)
B. 正反应为吸热反应,平衡常数:K(T1)>K(T2)
C. b中v(正)大于a中v(逆)
D. 达到平衡时,a、b、c中CO的转化率为b>c>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有I-、NH4+、Cu2+、SO32-,向该溶液中加入少量溴水,溶液呈无色,则下列关于溶液组成的判断正确的是( )。
①肯定不含I-;②肯定不含Cu2+;③肯定含有SO32-;④可能含有I-
A.①③ B.①②③ C.①③④ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某元素+2价离子的电子排布式为1s22s22p63s23p6,则该元素在周期表中属于( )
A. 第ⅤB族B. 第ⅡB族C. 第Ⅷ族D. 第ⅡA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】称取(NH4)2SO4和NH4HSO4混合物样品7.58g,加入含0.1mol NaOH的溶液,加热充分反应,生成NH3 1792mL(标准状况),则(NH4)2SO4和NH4HSO4的物质的量比为
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A. 若XY3分子中X原子处于正三角形的中心,则XY3分子为非极性分子
B. C2H5OH与C2H5Br相比,前者的沸点远高于后者,其原因是前者的分子间存在氢键
C. 同周期ⅠA族元素和 ⅦA族元素之间只能形成离子化合物
D. 由两种非金属元素组成的化合物分子中只可能有极性键,不会有非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物(NOx)、SO2和CO2等气体会造成环境问题。对燃煤废气进行化学方法处理,可实现绿色环保、节能减排、废物利用等目的。
(1)利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-572 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2=-1160 kJ·mol-1
写出甲烷将NO2还原为N2并生成气态水时的热化学方程式________。
(2)工业上利用CO2生成甲醇燃料,反应为:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1
将6 mol CO2和8 mol H2充入容器为2 L的密闭容器中,恒温下,H2的物质的量随时间变化如图1实线所示(图中字母后的数字表示对应坐标)。
①该反应在0 min~8 min内CO2的平均反应速率为________。

②仅改变某一条件再进行实验,测得H2物质的量变化如图1虚线所示。与实线相比,曲线Ⅰ改变的条件可能是________,曲线Ⅱ改变的条件可能是________。
(3)反应:CO(g)+2H2(g)![]() CH3OH(g) ΔH=-129.0 kJ/mol可用于合成甲醇。按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图2所示。下列说法正确的是________(填字母)
CH3OH(g) ΔH=-129.0 kJ/mol可用于合成甲醇。按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图2所示。下列说法正确的是________(填字母)
A.温度:T1>T2>T3
B.正反应速率:ν(a)>ν(c)、 ν(b)>ν(d)
C.平衡常数:K(a)>K(c)、 K(b)=K(d)
D.平均摩尔质量:M(a)>M(c)、M(b)>M(d)
(4)常温下,Ksp(BaCO3)=2.5×10-9,Ksp(BaSO4)=1.0×10-10,控制条件可实现如下沉淀转换:BaSO4(s)+CO32-(aq)![]() BaCO3(s)+SO42-(aq)该反应平衡常数K的表达式为:K=________,欲用1 L Na2CO3溶液将0.01 mol BaSO4全部转化为BaCO3,则Na2CO3溶液的最初浓度应不低于________。
BaCO3(s)+SO42-(aq)该反应平衡常数K的表达式为:K=________,欲用1 L Na2CO3溶液将0.01 mol BaSO4全部转化为BaCO3,则Na2CO3溶液的最初浓度应不低于________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com