
【题目】已知热化学方程式:
①2HI(g)![]() I2(g)+H2(g) △H=+9.48kJ·molˉ1
I2(g)+H2(g) △H=+9.48kJ·molˉ1
②2HI(g)![]() I2(s)+H2(g) △H=-26.48kJ·molˉ1
I2(s)+H2(g) △H=-26.48kJ·molˉ1
下列说法中正确的是
A. ①的反应物比②的反应物稳定
B. I2(s)=I2(g)△H=-35.96 kJ·mol-1
C. ①的产物总能量比②的产物总能量高
D. 1mol I2(s)中通入1mol H2(g),充分反应时吸收26.48kJ热量
【答案】C
【解析】A项,①和②的反应物相同,①的反应物和②的反应物稳定性相同;B项,①-②得I2(s)=I2(g)ΔH=+9.48kJ/mol-(-26.48kJ/mol)=+35.96kJ/mol;C项,①为吸热反应,①的产物总能量高于反应物总能量,②为放热反应,②的产物总能量低于反应物总能量;D项,I2(s)与H2(g)生成HI的反应为吸热反应,该反应是可逆反应。
A项,①和②的反应物相同,①的反应物和②的反应物稳定性相同,A项错误;B项,①-②得I2(s)=I2(g)ΔH=+9.48kJ/mol-(-26.48kJ/mol)=+35.96kJ/mol,B项错误;C项,①为吸热反应,①的产物总能量高于反应物总能量,②为放热反应,②的产物总能量低于反应物总能量,①和②的反应物总能量相等,①的产物总能量比②的产物总能量高,C项正确;D项,2HI(g)![]() I2(s)+H2(g)ΔH=-26.48kJ/mol,则I2(s)+H2(g)
I2(s)+H2(g)ΔH=-26.48kJ/mol,则I2(s)+H2(g)![]() 2HI(g)ΔH=+26.48kJ/mol,该反应是可逆反应,1molI2(s)中通入1molH2(g)充分反应吸收热量小于26.48kJ,D项错误;答案选C。
2HI(g)ΔH=+26.48kJ/mol,该反应是可逆反应,1molI2(s)中通入1molH2(g)充分反应吸收热量小于26.48kJ,D项错误;答案选C。


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】 己知化合物N是一种对氨基苯甲酸酯类物质,可作局部麻醉药。合成N的一种路线如下图:

已知以下信息:
①核磁共振氢谱显示B只有一种化学环境的氢,H苯环上有两种化学环境的氢;
②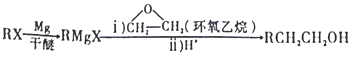
③E为芳香烃,其相对分子质量为92;
④![]() (苯胺,易被氧化)。
(苯胺,易被氧化)。
回答下列问题:
(1)A的化学名称是_______________,检验B中官能团的试剂是____________,N中官能团的名称是_________________。
(2)由E生成F的化学方程式为____________________________。
(3)由F生成G的反应类型为______________,H在一定条件下可以发生聚合反应,写出该聚合反应的化学方程式:_______________________。
(4)D的同分异构体中不能与金属钠反应生成氢气的共有________种(不考虑立体异构)。
(5)参照上述合成路线,以乙烯、干醚和环氧乙烷为原料(无机试剂任选)制备1,6-已二醛,设计合成路线:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,配制一组c(H2A)+c(HA-)+c(A2-)=0.10mol·L-1的H2A和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列说法正确的是
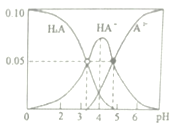
A. c(Na+)=0.10mol·L-1的溶液中,c(A2-)-c(H+)=c(H2A)-c(OH-)
B. pH=4的溶液中,c(HA-)=c(H2A)+c(A2-)
C. pH=7的溶液中,c(Na+)=c(A2-)+c(HA-)
D. K1(H2A)的数量级为10-5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】E、M、N、Q都是短周期元素,其原子序数依次增大。E原子核内仅含有1个质子;M原子的最外层电子数是次外层的3倍;N的原子半径是短周期元素中最大的;N与Q能够形成NQ型离子化合物。下列说法错误的是
A. 四种元素中只有一种是金属元素 B. Q的最高化合价为+7
C. N的最高价氧化物对应的水化物是一种强碱 D. 离子半径:M<N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.蛋白质的组成元素为碳、氢、氧、氮、硫
B.人体内油脂在小肠处水解
C.纤维素在人体内水解,为人体提供能量
D.海带提碘,灼烧时在蒸发皿中进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应mA(s)+nB(g)pC(g)△H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是( ) ①m+n>p
②x点表示的正反应速率大于逆反应速率
③n>p
④x点比y点时的反应速率慢
⑤若升高温度,该反应的平衡常数增大.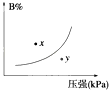
A.①②⑤
B.②④
C.①③
D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸钠( ![]() ,缩写为NaA)可用作饮料的防腐剂,研究表明苯甲酸(HA)的抑菌能力显著高于A﹣ , 已知25℃时,HA的Ka=6.25×10﹣5 , H2CO3的Ka1=4.17×10﹣7 , Ka2=4.90×10﹣11 , 在生产碳酸饮料的过程中,除了添加NaA外,还需加压冲入CO2气体,下列说法正确的是(温度为25℃,不考虑饮料中其他成分)( )
,缩写为NaA)可用作饮料的防腐剂,研究表明苯甲酸(HA)的抑菌能力显著高于A﹣ , 已知25℃时,HA的Ka=6.25×10﹣5 , H2CO3的Ka1=4.17×10﹣7 , Ka2=4.90×10﹣11 , 在生产碳酸饮料的过程中,除了添加NaA外,还需加压冲入CO2气体,下列说法正确的是(温度为25℃,不考虑饮料中其他成分)( )
A.相比于未充CO2的饮料,碳酸饮料的抑菌能力较低
B.提高CO2充气压力,饮料中c(A﹣)不变
C.当pH为5.0时,饮料中 ![]() =0.16
=0.16
D.碳酸饮料中各种粒子的浓度关系为:c(H+)=c(HCO3﹣)+c(CO32﹣)+c(OH﹣)﹣c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】书到用时方恨少,该题又是周期表;众里寻他千百度,答案还得自己找!下表是元素周期表中的一部分,回答下列问题:

(1)元素①的氢化物的化学式是________;该元素的一种氧化物是红棕色气体,请写出该气体溶于水时发生反应的离子方程式_________________________;
(2)原子半径:②____③(填“>”“ <”或“=”),
(3)元素④的名称是______;
(4)元素的非金属性:⑤_____⑥(填“>”或“<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com