
分析 (1)该反应中Mn元素化合价由+4价变为+2价,发生还原反应,被还原;
(2)1molMn元素化合价由+4价变为+2价,转移电子数为2mol;被被氧化的还原剂的物质的量是2mol;
(3)浓盐酸有一半的HCl作还原剂还有一半是酸性.
解答 解:(1)该反应中Mn元素化合价由+4价变为+2价,发生还原反应,被还原,故答案为:Mn;还原;
(2)1molMn元素化合价由+4价变为+2价,转移电子数为2mol;被被氧化的还原剂的物质的量是2mol,所以若消耗0.1molMnO2则被氧化的还原剂的物质的量是0.2mol,反应过程中转移电子的物质的量为0.2mol,故答案为:0.2;0.2;
(3)浓盐酸有一半的HCl作还原剂,表现还原性,还有一半是酸性,故答案为:还原性、酸性.
点评 本题考查氧化还原反应计算,为高频考点,侧重考查基本概念、基本计算,明确元素化合价变化与概念之间关系是解本题关键,注意:该反应中有一半盐酸作还原剂,一半盐酸体现酸性.


科目:高中化学 来源: 题型:选择题
| A. | C与浓HNO3反应 | B. | Cu与浓HNO3反应 | C. | Cu与稀HNO3反应 | D. | Mg(OH)2与HNO3反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
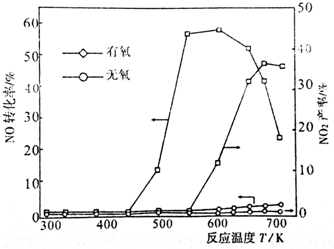
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2gH2的分子数为NA | |
| B. | 标准状况下,22.4LH2O含有NA个水分子 | |
| C. | 5.6g铁与足量盐酸反应转移的电子数为0.3NA | |
| D. | 1mol/LMg(NO3)2溶液中含有NO3-的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水呈淡黄绿色(HCl) | |
| B. | 新制氯水中滴加AgNO3溶液生成白色沉淀(Cl-) | |
| C. | 向NaHCO3溶液中加入新制氯水,有无色气泡(H+) | |
| D. | 将有色布条放入新制氯水中,有色布条褪色(HClO) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
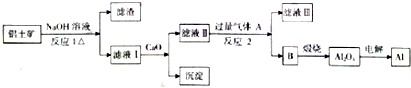
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 946kJ/mol | B. | 896kJ/mol | C. | 649kJ/mol | D. | 431kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
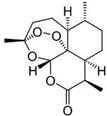
| A. | 化学是以实验为基础的一门学科,定量研究方法是化学发展为一门独立学科的重要标志之一 | |
| B. | 燃煤脱硫、汽车中加装尾气处理装置、利用二氧化碳制造全降解塑料、推广新能源汽车都能有效减少环境污染 | |
| C. | 我国科学家屠呦呦发现的青蒿素(结构见图),其中有类似于H2O2的结构,因此遇到强还原性的物质会变质 | |
| D. | 利用氢氧化铁胶体的“丁达尔效应“,可以除去水中的悬浮颗粒,从而达到净水的效果 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

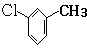 ,D分子中含氧官能团的名称为羧基,反应B→C的反应类型为取代反应.
,D分子中含氧官能团的名称为羧基,反应B→C的反应类型为取代反应.  ),下列有关G的叙述正确的是B.(填选项)
),下列有关G的叙述正确的是B.(填选项)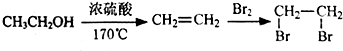
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com