
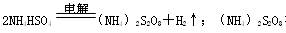 溶液送往水解器中减压水解、蒸发,蒸出过氧化氢的水溶液,剩余溶液流到阴极室再循环使用。
溶液送往水解器中减压水解、蒸发,蒸出过氧化氢的水溶液,剩余溶液流到阴极室再循环使用。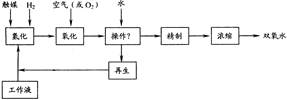
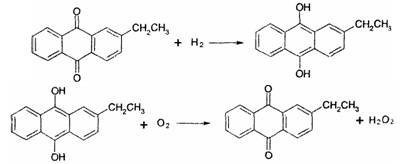
科目:高中化学 来源:不详 题型:填空题
 KIO3 +3H2↑。
KIO3 +3H2↑。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.⑴⑹ | B.⑴⑷ | C.⑷⑸ | D.⑵⑸ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 +
+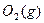 青
青 2
2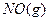 ;
;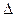 H=180.74KJ/mol.此反应称为伯克莱特—艾,某次雷雨闪电中两块云间的电势差为1×
H=180.74KJ/mol.此反应称为伯克莱特—艾,某次雷雨闪电中两块云间的电势差为1×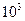 V,从一块云移到另一块云的电荷量为30000C,此次闪电释放出的能量为 KJ .
V,从一块云移到另一块云的电荷量为30000C,此次闪电释放出的能量为 KJ .查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
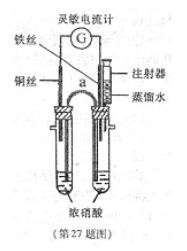
| 实验次数 | 实验温度(℃) | 注入水的体积(mL) |
| 1 | 17.2 | 2.4 |
| 2 | T1 | 2.5 |
| 3 | T2 | 2.3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.(189a+252b)g | B.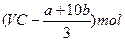 | C.(3a +2b)×63g +2b)×63g | D.(3a+4b)mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com