
 含硅元素的化合物广泛存在于自然界中,与其他矿物共同构成岩石.晶体硅(熔点 1410℃)用途广泛,制取与提纯方法有多种.
含硅元素的化合物广泛存在于自然界中,与其他矿物共同构成岩石.晶体硅(熔点 1410℃)用途广泛,制取与提纯方法有多种.分析 (1)根据炼钢的要求把生铁中的含碳量去除到规定范围,并使其它元素的含量减少或增加到规定范围的过程,简单地说,是对生铁降碳、去硫磷、调硅锰含量的过程;在使碳等元素降到规定范围后,钢水中仍含有大量的氧元素,是有害的杂质,使钢塑性变坏,轧制时易产生裂纹;
(2)每生成1.12kg纯硅需吸收akJ热量,则生成1mol纯硅吸收的热量为$\frac{a}{\frac{1.12×1{0}^{3}}{28}}$=0.025aKJ,据此写出反应热化学方程式;
A.强酸的钠盐不水解;
B.硅的卤化物(SiX4)是由非金属元素原子间通过共用电子对形成的化合物;
C.离子晶体的熔点大于分子晶体的熔点;
D.SiF4晶体属于分子晶体.
(3)硅烷的分解温度远低于甲烷的原因为:C和Si最外层电子数相同(或“是同主族元素”),C原子半径小于Si(或“C原子电子层数少于Si”) Si元素的非金属性弱于C元素,硅烷的热稳定性弱于甲烷;
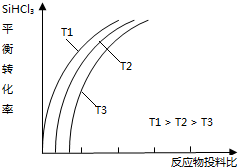
(4)a.因为随着温度的升高,SiHCl3的转化率增大,平衡右移,则该反应的平衡常数随温度升高而增大;
b.增大一种反应物的浓度,能提高其它反应物的转化率,而本身的转化率反而降低,故横坐标表示的投料比应该是$\frac{n({H}_{2})}{n(SiHC{l}_{3})}$;
c.降低压强平衡向气体系数减小方向移动;
(5)依据盐类水解规律“越弱越水解”解答.
解答 解:(1)炼钢的要求把生铁中的含碳量去除到规定范围,并使其它元素的含量减少或增加到规定范围的过程,简单地说,是对生铁降碳、去硫磷、调硅锰含量的过程,这一过程基本上是一个氧化过程,是用不同来源的氧(如空气中的氧、纯氧气、铁矿石中的氧)来氧化铁水中的碳、硅、锰等元素.化学反应主要是2FeO+Si$\frac{\underline{\;高温\;}}{\;}$2Fe+SiO2、FeO+Mn$\frac{\underline{\;高温\;}}{\;}$Fe+MnO;
在使碳等元素降到规定范围后,钢水中仍含有大量的氧,是有害的杂质,使钢塑性变坏,轧制时易产生裂纹,故炼钢的最后阶段必须加入脱氧剂(例如锰铁、硅铁和铝等),以除去钢液中多余的氧:Mn+FeO$\frac{\underline{\;高温\;}}{\;}$MnO+Fe,Si+2FeO$\frac{\underline{\;高温\;}}{\;}$SiO2+2Fe,Al+3FeO$\frac{\underline{\;高温\;}}{\;}$Al2O3+3Fe,
故选:CD;
(2)由题意可知:每生成1.12kg纯硅需吸收akJ热量,则生成1mol纯硅吸收的热量为$\frac{a}{\frac{1.12×1{0}^{3}}{28}}$=0.025aKJ,所以该反应的热化学方程式:SiCl4(g)+2H2(g)→Si(s)+4HCl(g)△H=-0.025akJ/mol;
A.钠的强酸盐不水解,NaX(NaF除外)不易水解,故A错误;
B.硅的卤化物(SiX4)是由非金属元素原子间通过共用电子对形成的化合物,是共价化合物,故B正确;
C.钠的卤化物(NaX)为离子化合物属于离子晶体,硅的卤化物(SiX4)为共价化合物属于分子晶体,离子晶体的熔点大于分子晶体的熔点,即NaX的熔点一般高于SiX4,故C正确;
D.SiF4晶体是由分子间作用力结合而成,故D错误;
故答案为:SiCl4(g)+2H2(g)→Si(s)+4HCl(g)△H=-0.025akJ/mol; BC;
(3)C和Si最外层电子数相同(或“是同主族元素”),C原子半径小于Si(或“C原子电子层数少于Si”) Si元素的非金属性弱于C元素,硅烷的热稳定性弱于甲烷,故硅烷的分解温度远低于甲烷.
故答案为:C和Si最外层电子数相同(或“是同主族元素”),C原子半径小于Si(或“C原子电子层数少于Si”) Si元素的非金属性弱于C元素,硅烷的热稳定性弱于甲烷;
(4)a.因为随着温度的升高,SiHCl3的转化率增大,平衡右移,则该反应的平衡常数随温度升高而增大,故a正确;
b.增大一种反应物的浓度,能提高其它反应物的转化率,而本身的转化率反而降低,故横坐标表示的投料比应该是$\frac{n({H}_{2})}{n(SiHC{l}_{3})}$,故b错误;
c.SiHCl3(g)+H2(g)?Si(s)+3HCl(g)正向为气体系数减小方向,降低压强平衡向气体系数减小方向移动,可以提高SiHCl3的利用率,故c正确;
故选:a、c;
(5)依据所给数据可知:硅酸的Ki2小于碳酸的Ki2,依据“越弱越水解”可知硅酸钠更易水解,
故答案为:硅酸钠;硅酸的Ka2小于碳酸的Ka2,硅酸钠更易水解.
点评 本题为综合题考查了高炉炼铁原理、热化学方程式书写、化学平衡移动影响因素、盐类水解规律,题目难度中等,注意对化学平衡移动知识的掌握.


 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 甲、乙、丙、丁、戊五种物质中,甲、乙、丙均含有相同的某种元素,丁是一种常见气体单质,它们之间具有如图所示转化关系.下列有关物质的推断不正确的是( )
甲、乙、丙、丁、戊五种物质中,甲、乙、丙均含有相同的某种元素,丁是一种常见气体单质,它们之间具有如图所示转化关系.下列有关物质的推断不正确的是( )| A. | 若甲为Na,则戊可能是H2O | B. | 若甲为C2H4,则戊可能是O2 | ||
| C. | 若甲为NO,则戊可能是H2O | D. | 若甲为Cl2,则戊可能是NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气具有还原性,可用于检查HCl泄漏 | |
| B. | 浓硫酸具有吸水性,可用于干燥CO2 | |
| C. | 铝具有高熔点,可用于生产耐火砖 | |
| D. | 硅有导电性,可用作光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | K2Cr2O7溶液 | Cr(OH)3 | Cr3+溶液 |
| 颜色 | 橙黄色 | 灰绿色沉淀 | 灰绿色 |
| Fe(OH)3 | Cr(OH)3 | |
| 开始沉淀时 | 1.5 | 6.0 |
| 沉淀完全时 | 2.8 | 8.0 |
| 实验 序号 | 实验装置 | 实验电压 | 溶液 | 时间 | 现象 |
| Ⅰ |  | 22V | 0.01mol/L K2Cr2O7溶液 | 20 分钟 | a 极区无明显现象; b 极区有无色气泡. |
| 实验 序号 | 实验装置 | 实验电压 | 溶液 | 时间 | 现象 |
| Ⅱ |  | 22V | 0.01mol/LK2Cr2O7溶液中加入少量H2SO4酸 化,使pH≈1 | 20 分钟 | a 极区溶液变浅绿色; b极区有无色气泡产生,产生红褐色沉淀. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
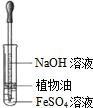
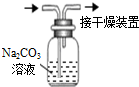
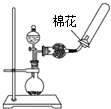
| A.观察Fe(OH)2 的生成 | B.中和滴定 | C.除去CO2气体中 的HCl气体 | D.制取并收集干燥 的氨气 |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相等 | B. | 前者大于后者 | C. | 后者大于前者 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高一上10月月考化学试卷(解析版) 题型:选择题
对于某些离子的检验及结论正确的是
A.加入紫色石蕊试液,溶液变蓝,证明溶液中含有较多的H+
B.加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有Cl-
C.加入稀硫酸后,生成能使澄清石灰水变浑浊的气体,可确定有大量的CO32-
D.加入盐酸酸化时无现象,再滴入BaCl2溶液,产生白色沉淀,可确定有SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学反应速率的客观因素有许多,如温度、浓度、压强、催化剂、表面积等,因此探究客观条件与化学反应速率关系的实验设计及改进也就许许多多.
化学反应速率的客观因素有许多,如温度、浓度、压强、催化剂、表面积等,因此探究客观条件与化学反应速率关系的实验设计及改进也就许许多多.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com