
| |||||||||||||||||||||||||
科目:高中化学 来源:福建省晋江市四校2012届高三第二次联合考试化学试题 题型:058
合金已成为飞机制造、化工生产等行业的重要材料.研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究.填写下列空白.
[实验方案一]将铝镁合金与足量NaOH溶液反应,测定剩余固体质量.实验中发生反应的化学方程式是________
[实验步骤]
(1)称取5.4 g铝镁合金粉末样品,溶于V mL 2.0 mol/L NaOH溶液中,充分反应.则NaOH溶液的体积V≥________.
(2)过滤、洗涤、干燥、称量固体.该步骤中若未洗涤固体,测得镁的质量分数将________(填“偏高”、“偏低”或“无影响”).
[实验方案二]将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01×105 Pa)的体积.
[问题讨论]
(3)同学们拟选用下列实验装置完成实验:
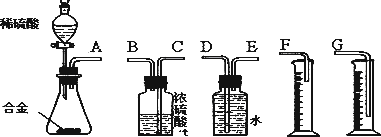
①你认为最简易的装置其连接顺序是(填接口字母,可不填满):
A接( )( )接( )( )接( )
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶.请你帮助分析原因.________.
③实验结束时,在读取测量实验中生成氢气的体积时,你认为合理的是________.
A.待实验装置冷却后再读数
B.上下移动量筒F,使其中液面与广口瓶中液面相平
C.上下移动量筒G,使其中液面与广口瓶中液面相平
D.视线与凹液面的最低点水平,读取量筒中水的体积
查看答案和解析>>
科目:高中化学 来源:2012-2013学年陕西省宝鸡市高三第三次模拟理综化学试卷(解析版) 题型:实验题
某研究性学习小组为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计了下列三种不同实验方案进行探究,请根据他们的设计回答有关问题。
【探究一】实验方案: 。
。
问题讨论:(1)实验中发生反应的化学方程式是 。
(2)若实验中称取5.4g铝镁合金粉末样品,投入VmL2.0mol/L NaOH溶液中,充分反应。则NaOH溶液的体积V≥ mL。
(3)实验中,当铝镁合金充分反应后,在称量剩余固体质量前,还需进行的实验操作按顺序依次为 。
【探究二】实验方案:称量xg铝镁合金粉末,放在如图所示装置的惰性电热板上,通电使其充分灼烧。
问题讨论:(4)欲计算Mg的质量分数,该实验中还需测定的数据是 。

(5)假设实验中测出该数据为yg,则原铝镁合金粉末中镁的质量分数为 (用含x、y代数式表示)。
[探究三]实验方案: 。
。
问题讨论:(6)同学们拟选用下边的实验装置完成实验,你认为最简易的装置其连接顺序是:
a接 。(填接口字母,仪器不一定全选。)

(7)同学们仔细分析(6)中连接的实验装置后,又设计了下左图所示的实验装置。

①装置中导管a的作用是 。
②实验前后碱式滴定管中液面读数分别如上右图,则产生氢气的体积为 mL。
③与上左图装置相比,用(6)中连接的装置进行实验时,容易引起误差的原因是 (任写一点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
含镁3%~5%的铝镁合金,现已成为轮船制造、化工生产、机械制造等行业的重要原材料。现有一块已知质量的铝镁合金,欲测定其中镁的质量分数,几位同学设计了不同的实验方案。
实验设计1:铝镁合金![]() 测定生成气体的体积(标准状况)
测定生成气体的体积(标准状况)
实验设计2:铝镁合金![]() 测定生成气体的体积(标准状况)
测定生成气体的体积(标准状况)
实验设计3:镁铝合金![]() 溶液
溶液![]() 过滤,测定沉淀的质量
过滤,测定沉淀的质量
回答下列问题:
(1)写出实验设计2方案中有关化学反应方程式
(2)若按实验设计3进行实验,实验过程需要的主要仪器有 (写出3种仪器名称)。将m g镁铝合金,溶于过量盐酸中,再加入过量的NaOH溶液,可得到白色沉淀,该沉淀物质是 (填分子式);将此沉淀洗净、干燥后,称得质量为w g。求合金中镁的质量分数 ;
(3)下列各实验方案中,能测出合金中镁的质量分数的是 。
A.实验设计1 B.实验设计2 C.实验设计3 D.都可以
查看答案和解析>>
科目:高中化学 来源: 题型:
含镁3%-5%的镁铝合金,现已成为轮船制造、化工生产、机械制造等行业的重要原材料。现有一块已知质量为![]() g的镁铝合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案:
g的镁铝合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案:
实验设计1:镁铝合金![]() 充分反应后测定剩余固体质量
充分反应后测定剩余固体质量![]() g
g
实验设计2:镁铝合金![]() 生成的气体在标准状况下的体积为VL。
生成的气体在标准状况下的体积为VL。
请回答以下问题:
(1) 实验设计1:
①镁的质量分数: 。
②在溶解、过滤中使用的玻璃仪器有 __________ 。
③过滤后洗涤沉淀的操作方法是________________________________________
____________________________________________________。
④如果过滤得到沉淀没有用蒸馏水洗涤数次后,烘干,再测定剩余固体质量。测得镁的质量分数量会 (填“偏大”、“偏小”或“无影响”)。
(2)  实验设计2:测定生成的气体装置如右图,
实验设计2:测定生成的气体装置如右图,
进行的操作有:
a.记录C的液面位置;
b.待B中不再有气体产生并恢复至室温后,记录C的液面位置;
c.检查气密性;
d.将药品和水装入各仪器中,连接好;
e.由A向B中滴加足量试剂。
①上述操作的顺序是:_______________________________(填序号)。
②记录C的液面位置时,除视线平视外,还应注意:
___________________________________________________________。
![]()
![]() (3)请你利用实验设计1和实验设计2的模式再设计一个实验方案:
(3)请你利用实验设计1和实验设计2的模式再设计一个实验方案:
铝镁合金 ![]() 溶液
溶液 ![]() 过滤,测定质量。
过滤,测定质量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com