下列说法正确的是( )
A.将100g 10%的盐酸加热蒸发,得到50克溶液,其浓度为20%
B.把100 mL 3 mol/L的硫酸跟100 mL H2O混合,所得溶液物质的量浓度大于1.5 mol/L
C.把200 mL 3 mol/L的BaCl2溶液跟100 mL 3 mol/L的KCl溶液混合后,溶液中的c(Cl-)仍然是3 mol/L
D.已知某温度KNO3的溶解度是31.6 g/100g水,在该温度下将20g KNO3溶解于50 g水中,所得溶液的质量分数是28.6%
【答案】
分析:A.加热HCl挥发,盐酸的浓度降低;
B.混合后所得硫酸的体积小于200m;
C.3 mol/L的BaCl
2溶液中c(Cl
-)是6mol/L,两溶液中氯离子的浓度不相同;
D.某温度KNO
3的KNO
3的溶解度是31.6 g/100g水,则该温度下50g水中溶解KNO
3的质量为15.8g,为饱和溶液,根据质量分数计算.
解答:解:A.加热HCl挥发,盐酸的浓度降低,故A错误;
B.微粒之间具有间隙,混合后所得硫酸的体积小于200mL,故所得溶液物质的量浓度大于1.5 mol/L,故B正确;
C.3mol?L
-1的BaCl
2溶液中氯离子浓度为6mol?L
-1,3mol?L
-1的KCl溶液中氯离子浓度为L3mol?L
-1,混合后氯离子浓度,介于之间3mol?L
-1~6mol?L
-1,故C错误;
D.某温度KNO
3的KNO
3的溶解度是31.6 g/100g水,则该温度下50g水中溶解KNO
3的质量为31.6g×
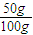
=15.8g,为饱和溶液,所得溶液的质量分数是
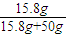
×100%=24.01%,故D错误;
故选B.
点评:考查物质的量浓度与质量分数混合计算,难度中等,注意溶液混合体积不具备加合性,A为易错点,容易忽略溶质挥发性.

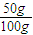 =15.8g,为饱和溶液,所得溶液的质量分数是
=15.8g,为饱和溶液,所得溶液的质量分数是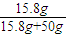 ×100%=24.01%,故D错误;
×100%=24.01%,故D错误;

 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案
 Sn(s,白)△H3=+2.1kJ?mol-1,
Sn(s,白)△H3=+2.1kJ?mol-1,