
| A. | ①④ | B. | ②③ | C. | ②③ | D. | ②③④ |
分析 短周期的A、B两种元素,如果同周期,A原子序数小于B,A为正价;不同周期A原子序数小于B,则A应在第二周期,B在在第三周期;两种元素可形成A是正价的AB2型化合物,则A为+2或+4价,则A应为第二周期IIA族或IVA族元素,以此来解答.
解答 解:①若在同周期,A为正价,A在B的前面,则A原子序数小于B,A应为第二周期IIA族或IVA族元素,如氟化铍或二氧化碳,故①正确;
②A不一定是B的前一周期元素,也可以是同周期,故②错误;
③两种元素可形成A是正价的AB2型化合物,则A为+2或+4价,即A为C时属于非金属元素,故③错误;
④两种元素可形成A是正价的AB2型化合物,则A为+2或+4价,则A应为第二周期IIA族或IVA族元素,故④正确;
故选A.
点评 本题考查位置、结构、性质,明确原子半径和化合价来确定元素的位置是解答本题的关键,题目难度中等.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:填空题
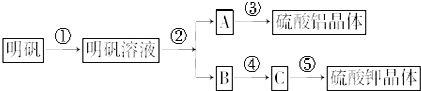
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ,•mol-1.(注:燃烧热:1mol燃料完全燃烧所放出的能量即为该燃料的燃烧热.)请回答下列问题:
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ,•mol-1.(注:燃烧热:1mol燃料完全燃烧所放出的能量即为该燃料的燃烧热.)请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L苯中所含的分子数为0.5NA | |
| B. | 标准状况下,22.4L O2与44.8L SO2充分反应后转移电子的数目为4NA | |
| C. | 各为0.1mol的H3O+和OH-中含有的电子数目均为0.9NA | |
| D. | 2.4g O2和O3的组成的混合气体中所含的氧原子数目为0.15NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti 原子中均含22个中子 | |
| B. | 分别由${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti 组成的金属钛单质互称同分异构体 | |
| C. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti 在周期表中位置相同,都在第四周期 | |
| D. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti为同一核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
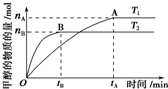
 煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
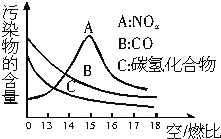 稀薄燃烧是指汽油在较大空/燃比(空气与燃油气的体积比)条件下的燃烧.随着全球能源危机的加剧,稀薄燃烧技术的研究受到了人们的重视,但稀薄燃烧时,现用的汽油尾气净化装置不能有效地将NOx转化为N2.不同空/燃比时汽车尾气中主要污染物的含量变化如图所示.
稀薄燃烧是指汽油在较大空/燃比(空气与燃油气的体积比)条件下的燃烧.随着全球能源危机的加剧,稀薄燃烧技术的研究受到了人们的重视,但稀薄燃烧时,现用的汽油尾气净化装置不能有效地将NOx转化为N2.不同空/燃比时汽车尾气中主要污染物的含量变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 磷酸的电离:H3PO4?3H++PO43- | |
| B. | 甲烷的燃烧为-890.3KJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3KJ•mol-1 | |
| C. | 实验室制取氢氧化铁胶体:Fe3++3H2O?Fe(OH)3(胶体)+3H+ | |
| D. | 用双氧水处理含NaCN的碱性废水:2CN-+5H2O2+2OH-═2CO32-+N2↑+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com