


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
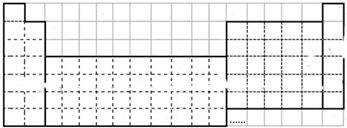

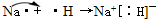
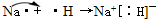
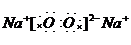
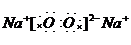
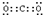
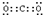
查看答案和解析>>
科目:高中化学 来源:2013届河南省许昌市高一下学期第四次五校联考化学试卷 题型:填空题
(1)带有2个单位正电荷的微粒 ,质量数A是137,中子数N
,质量数A是137,中子数N
是81,2.74g该微粒所含有的电子约为 mol。(2分)
(2)某元素最高价氧化物的化学式是RO2,已知其气态氢化物中含氢25% 。
①计算R的相对原子质量为 (2分);
②写出R最高价氧化物对应的水化物的化学式 (1分).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com