
(16分)MnO2与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl,K2MnO4溶液经酸化后转化为MnO2和KMnO4。一种MnO2制备KMnO4的方法如下:
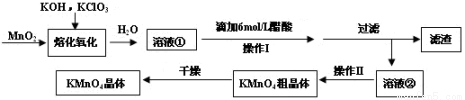
(1)写出“溶化氧化”的化学反应方程式: ;
(2)从溶液②中得到KMnO4粗晶体的方法是 ;
(3)上述流程中可以循环使用的物质是 ;
(4)理论上(若不考虑制备过程中的损失与物质循环)1mol MnO2可制的 mol KMnO4;
(5)已知293K时醋酸钾的溶解度为217g,硫酸钾的溶解度为11.1g,请解释酸化过程中采用醋酸而不采用盐酸或硫酸的原因:
①不采用盐酸的原因: ;
②不采用硫酸的原因: 。
(6)采用上述流程制备KMnO4产率并不高,为提高产率,还可以采用以下两种方法:
①在K2MnO4溶液中通入氯气,写出该反应的离子方程式 ;
②电解K2MnO4溶液,电解的总反应离子方程式为 。
(1)6KOH + KClO3 + 3MnO2  3K2MnO4 + KCl + 3H2O (3分)
3K2MnO4 + KCl + 3H2O (3分)
(2)蒸发浓缩、冷却结晶、过滤 (2分)
(3)MnO2 (2分)
(4)2/3 (2分)
(5)①盐酸具有还原性,高锰酸钾具有强氧化性,会产生氯气 (1分)
②硫酸钾溶解度降低,在蒸发浓缩过程中容易析出而造成产品高锰酸钾纯度下降(1分)
(6)2MnO42- + Cl2 = 2MnO4- + 2Cl-(2分)
2MnO42- + 2H2O = 2MnO4- + 2OH- + H2↑(3分)
【解析】
试题分析(1)第一步从流程中找到反应物和部分生成物,再根据电荷守恒配平相应变价的元素,最后用电荷守恒进一步配平即可
(2)关键在于审题“溶液②中得到KMnO4粗晶体”
(3)可循环物质为可以从“加进去”和“析出来”的物质进行考滤
(4)根据6KOH + KClO3 + 3MnO2 = 3K2MnO4 + KCl + 3H2O
和 3MnO42- + 4H+ = 2MnO4- + MnO2 ↓+ 2H2O
建立关系式:3MnO2 ~ 3MnO42- ~ 2MnO4-
根据系数进行计算即可
(5)①由制氯气的方法盐酸与高锰酸钾反应可知
②由给出的溶解度“硫酸钾的溶解度为11.1g”可知
(6)①由题意可知,锰酸钾要转化为高锰酸钾要被氧化,而氯气则充当氧化性
②锰酸钾要转化为高锰酸钾,则锰酸根要在阳极放电,根据锰酸钾溶液的离子成份,类似于电解饱和食盐水。
考点:氧化还原反应及有关计算;分离和担纯的方法;电化学中电解池的电极反应式的书写。


 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源:2013-2014广东省惠州市高一下学期期末考试化学(理)试卷(解析版) 题型:选择题
假酒中严重超标的有毒成分是:
A.CH3CH2OH B.CH3OH C.CH3COOCH2CH3 D.CH3COOH
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省广州市越秀区高二下学期期末水平调研化学试卷(解析版) 题型:选择题
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环。下列说法不正确的是
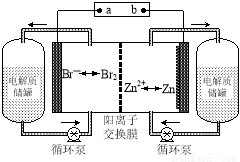
A.充电时电极a连接电源的负极
B.放电时负极的电极反应式为Zn—2e-=Zn2+
C.放电时左侧电解质储罐中的离子总浓度增大
D.阳离子交换膜可阻止Br2与Zn直接发生反应
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省高三5月第三次模拟理综化学试卷(解析版) 题型:填空题
(16分)海水资源的利用具有广阔前景。海水中主要离子的含量如下:
成分 | 含量/(mg?L-1) | 成分 | 含量/(mg?L-1) |
Cl- | 18980 | Ca2+ | 400 |
Na+ | 10560 | HCO3- | 142 |
SO42 | 2560 | Br- | 64 |
Mg2+ | 1272 |
|
|
电渗析法淡化海水示意图如图所示,其中阴(阳)
离子交换膜仅允许阴(阳)离子通过。

①阳极主要电极反应式是 。
②在阴极附近产生少量白色沉淀,其成分有 和CaCO3,
生成CaCO3的离子方程式是 。
③淡水的出口为 (填“a”、“b”或“c”)。
(2)利用海水可以提取溴和镁,提取过程如下: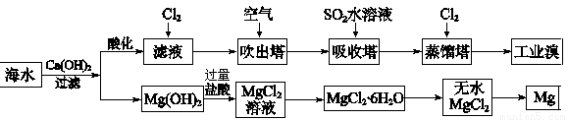
①提取溴的过程中,经过2次Br-→Br2转化的目的是 ,吸收塔中发生反应的离子方程式是 。解释通空气的目的是 。
②从MgCl2溶液中得到MgCl2·6H2O晶体的主要操作是 、过滤、洗涤、干燥。
③依据上述流程,若将10 m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为
L(忽略Cl2溶解,溴的相对原子质量:80)。
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省高三5月第三次模拟理综化学试卷(解析版) 题型:选择题
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
选项 | 叙述Ⅰ | 叙述Ⅱ |
A | NH4Cl为强酸弱碱盐 | 用加热法除去NaCl中的NH4Cl |
B | Fe3+具有氧化性 | 用KSCN溶液可以鉴别Fe3+ |
C | 溶解度:CaCO3<Ca(HCO3)2 | 溶解度:Na2CO3<NaHCO3 |
D | SiO2可与HF反应 | 氢氟酸不能保存在玻璃中 |
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省高三5月综合测试理综化学试卷(解析版) 题型:选择题
X、Y、P、Q四种短周期元素,元素X在地壳中含量最高,充有元素Y单质蒸气的灯透雾能力强,常用于道路和广场的照明,Q的最外层电子数与其电子总数比为3:8,P的单质常用作电脑的芯片材料。
A.元素Y、P的简单氢化物中化学键类型相同
B.原子半径:X>Y
C.最高价氧化物的水化物酸性:P<Q
D.X、Q两元素的最高正化合价相同
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省佛山市高三教学质量检测二理综化学试卷(解析版) 题型:简答题
(16分)高铁酸钠(Na2FeO4)具有很强的氧化性,广泛应用于净水、电池工业等领域。以粗FeO(含有CuO、Al2O3和SiO2等杂质)制备高铁酸钠的生产流程如下,回答下列问题:
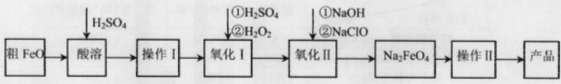
已知:NaClO不稳定,受热易分解。
(1)粗FeO酸溶过程中通入水蒸气(高温),其目的是__________________________。
(2)操作I目的是得到高纯度FeSO4溶液,则氧化I中反应的离子方程式为_________。
(3)本工艺中需要高浓度NaClO溶液,可用Cl2与NaOH溶液反应制备
①Cl2与NaOH溶液反应的离子方程式为_________________。
②在不同温度下进行该反应,反应相同一段时间后,测得生成NaClO浓度如下:
温度/℃ | 15 | 20 | 25 | 30 | 35 | 40 | 45 |
NaClO浓度/mol·L-1 | 4.6 | 5.2 | 5.4 | 5.5 | 4.5 | 3.5 | 2 |
请描述随温度变化规律________________________________________________________。
其原因为____________________________________________________________________。
(4)工业也常用电解法制备Na2FeO4,其原理为Fe+2OH-+2H2O电解FeO42-+3H2↑。请用下列材料设计电解池并在答题卡的方框内画出该装置。

可选材料:铁片、铜片、碳棒、浓NaOH溶液、浓HCl等
其阳极反应式为:________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省高二下学期期中化学试卷(解析版) 题型:选择题
CaC2和ZnC2、Al4C3、Mg2C3、Li2C2等都同属于离子型碳化物,请通过CaC2制C2H2的反应进行思考,从中得到必要的启示,判断下列反应产物正确的是?
A.ZnC2水解生成乙烷 B.Al4C3水解生成甲烷?
C.Mg2C3水解生成丙烯 D.Li2C2水解生成乙炔?
查看答案和解析>>
科目:高中化学 来源:2013-2014广东清远市市高二下学期期末考试化学试卷(解析版) 题型:选择题
维生素C的结构简式为: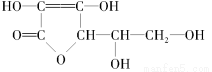
香油酚的结构简式为: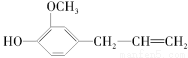
下列关于二者所含官能团的说法正确的是
A.均含酯基 B.均含醇羟基和酚羟基
C.均含碳碳双键 D.均为芳香族化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com