
标准状况下,aL气体X2和bL气体Y2恰好完全反应生成cL气体Z,若2a=6b=3c,则Z的化学式为
A.X3Y B.XY3 C.XY2 D.X2Y
科目:高中化学 来源: 题型:解答题

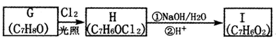
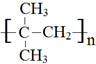 .
.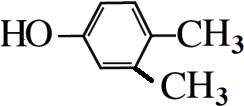 .
.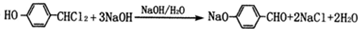 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾可作净水剂 | |
| B. | 硅可制作半导体材料 | |
| C. | 氢氧化钠常用于中和胃酸 | |
| D. | 常温下,铁制容器可用于盛装浓硫酸 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高一上10月月考化学试卷(解析版) 题型:选择题
己知:60℃ 时,KNO3的溶解度为110g。在此温度下,向盛有l00mL水的烧杯中投入101g KNO3后充分搅拌,此烧杯中将会得到
A.悬浊液 B.饱和溶液
C.质量分数约为50%的溶液 D.物质的量浓度为10mol/L的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,K+、Fe2+、SCN-、Br-可以大量共存 | |
| B. | 与KI溶液反应的离子方程式为Fe3++2I-═Fe2++I2 | |
| C. | 与Na2CO3溶液反应的离子方程式为2Fe3++3CO32-+3H2O═2Fe(OH)3↓+3CO2↑ | |
| D. | 与Mg(OH)2悬浊液反应的离子方程式为3OH-+Fe3+═Fe(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 甲、乙、丙、丁、戊五种物质中,甲、乙、丙均含有相同的某种元素,丁是一种常见气体单质,它们之间具有如图所示转化关系.下列有关物质的推断不正确的是( )
甲、乙、丙、丁、戊五种物质中,甲、乙、丙均含有相同的某种元素,丁是一种常见气体单质,它们之间具有如图所示转化关系.下列有关物质的推断不正确的是( )| A. | 若甲为Na,则戊可能是H2O | B. | 若甲为C2H4,则戊可能是O2 | ||
| C. | 若甲为NO,则戊可能是H2O | D. | 若甲为Cl2,则戊可能是NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
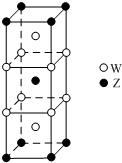 短周期元素T、X、Y、Z的原子序数依次增大,其中元素T、X基态原子均有2个未成对电子,元素Y基态原子s能级的电子总数与p能级的电子总数相等,元素Z的价电子数等于能层数.元素W位于第四周期,其基态原子所含未成对电子数在该周期中最多.
短周期元素T、X、Y、Z的原子序数依次增大,其中元素T、X基态原子均有2个未成对电子,元素Y基态原子s能级的电子总数与p能级的电子总数相等,元素Z的价电子数等于能层数.元素W位于第四周期,其基态原子所含未成对电子数在该周期中最多. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | K2Cr2O7溶液 | Cr(OH)3 | Cr3+溶液 |
| 颜色 | 橙黄色 | 灰绿色沉淀 | 灰绿色 |
| Fe(OH)3 | Cr(OH)3 | |
| 开始沉淀时 | 1.5 | 6.0 |
| 沉淀完全时 | 2.8 | 8.0 |
| 实验 序号 | 实验装置 | 实验电压 | 溶液 | 时间 | 现象 |
| Ⅰ |  | 22V | 0.01mol/L K2Cr2O7溶液 | 20 分钟 | a 极区无明显现象; b 极区有无色气泡. |
| 实验 序号 | 实验装置 | 实验电压 | 溶液 | 时间 | 现象 |
| Ⅱ |  | 22V | 0.01mol/LK2Cr2O7溶液中加入少量H2SO4酸 化,使pH≈1 | 20 分钟 | a 极区溶液变浅绿色; b极区有无色气泡产生,产生红褐色沉淀. |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高一上10月月考化学试卷(解析版) 题型:选择题
9月15日22时04分09秒,长征二号FT2火箭托举着天宫二号空间实验室腾空而起,成功送上太空。该火箭所用的推进燃料偏二甲肼(化学式为C2H8N2),下列说法中正确的是
A.lmolC2H8N2中含有lmolN2
B.偏二甲肼的摩尔质量为60g
C.偏二甲肼是比液氢更环保的燃料
D.偏二甲肼燃烧时能放出大量的热和气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com