
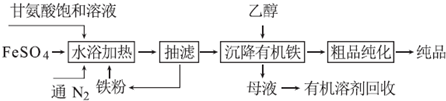
分析 甘氨酸亚铁络合物合成流程:甘氨酸饱和溶液通入氮气,防止Fe2+被氧气氧化或搅拌以加快化学反应速率,甘氨酸显弱酸性,加入铁粉2NH2CH2COOH+Fe=(NH2CH2COO)2Fe+H2↑,水浴加热甘氨酸饱和溶液和硫酸亚铁的混合物,离子反应为:2NH2CH2COOH+Fe2+?(NH2CH2COO)2Fe+2H+,抽滤为减压过滤,能加快过滤的速度,然后用乙醇沉降有机铁,采用蒸馏的方法从母液中回收有机物,将粗品醇化得到纯品.
(1)气体充入溶液中能起搅拌作用,亚铁离子易被氧气氧化,氮气能防止亚铁离子被氧化;
(2)羧基具有酸性,与铁反应生成亚铁离子,亚铁离子和甘氨酸反应生成络合物;
(3)抽滤为减压过滤,能加快过滤的速度,采用蒸馏的方法从母液中回收有机物;
(4)甘氨酸亚铁络合物[化学式为(NH2CH2COO)2Fe]为有机络合物,粗品纯化采用无水乙醇(或丙酮等)洗涤,真空干燥机能低温脱水干燥;
(5)甘氨酸显弱酸性,投入适量的石灰石,使H+浓度降低,有利于反应向生成甘氨酸亚铁络合物的方向进行,同时生成微溶的硫酸钙,降低硫酸根离子的浓度;
(6)根据氮原子守恒,产率为=$\frac{试剂产出纯品}{理论纯品}$×100%.
解答 解:(1)甘氨酸饱和溶液通入氮气,气流通过溶液,能起搅拌溶液的作用,搅拌以加快化学反应速率,水浴加热甘氨酸饱和溶液和硫酸亚铁的混合物,亚铁离子易被氧气氧化,氮气为保护气,通入氮气,防止Fe2+被氧气氧化,
故答案为:防止Fe2+被氧气氧化或搅拌以加快化学反应速率;
(2)甘氨酸显弱酸性,加入铁粉2NH2CH2COOH+Fe=(NH2CH2COO)2Fe+H2↑,水浴加热甘氨酸饱和溶液和硫酸亚铁的混合物,离子反应为:2NH2CH2COOH+Fe2+?(NH2CH2COO)2Fe+2H+,
故答案为:2NH2CH2COOH+Fe=(NH2CH2COO)2Fe+H2↑;2NH2CH2COOH+Fe2+?(NH2CH2COO)2Fe+2H+;
(3)抽滤是指用抽气泵使瓶中的压强降低,达到固液分离的目的,能加快过滤的速度,互溶的液体采用蒸馏的方法分离,所以采用蒸馏的方法从母液中回收有机物,
故答案为:加快过滤的速度;蒸馏;
(4)甘氨酸亚铁络合物[化学式为(NH2CH2COO)2Fe]为有机络合物,粗品纯化采用无水乙醇(或丙酮等)洗涤,有机物的沸点较低,采用真空干燥机能实现在低温条件下加热脱水干燥,所以选择真空干燥机干燥,
故答案为:无水乙醇(或丙酮等);真空干燥机;
(5)甘氨酸显弱酸性,其结构简式为NH2CH2COOH,投入适量的石灰石,石灰石消耗H+,使H+浓度降低,有利于反应2NH2CH2COOH+Fe2+?(NH2CH2COO)2Fe+2H+,向生成甘氨酸亚铁络合物的方向进行,同时,Ca2+与SO42-反应生成CaSO4沉淀,降低了杂质离子SO42-的浓度,
故答案为:石灰石消耗H+,使H+浓度降低,有利于反应向生成甘氨酸亚铁络合物的方向进行,同时,Ca2+与SO42-反应生成CaSO4沉淀,降低了杂质离子SO42-的浓度;
(6)甘氨酸的投料量为300kg,甘氨酸的物质的量n=$\frac{300×1{0}^{3}g}{75g/mol}$=4×103mol,生成n[(NH2CH2COO)2Fe]=2×103mol,产率为=$\frac{试剂产出纯品}{理论纯品}$×100%=$\frac{346.8×1{0}^{3}g}{2×1{0}^{3}mol×204g/mol}$=85%,
故答案为:85%.
点评 本题考查甘氨酸亚铁络合物制备实验,为高频考点,把握制备的反应原理及发生的反应为解答的关键,侧重分析、实验能力的综合考查,题目难度中等.


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:解答题
 短周期元素甲~戊的原子序数依次增大,结合表中信息,回答有关问题.
短周期元素甲~戊的原子序数依次增大,结合表中信息,回答有关问题.| 甲 | 乙 | 丙 | 丁 | 戊 | |
| 主要化合价 | +1、-1 | +4、-4 | |||
| 性质或结构信息 | 同位素有3种 | 同素异形体有多种 | 2s22p4 | 五种原子中原子半径最大,未成对电子数为0 | 有两种常见氧化物,其中一种是大气污染物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
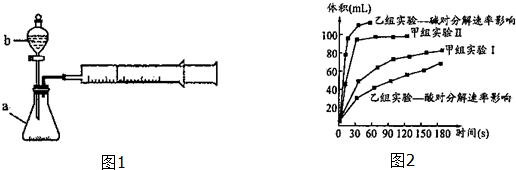
| 实验编号 | 实验目的 | t℃ | 催化剂 | 浓度 |
| 甲组实验Ⅰ | 做实验参照 | 25 | 3滴FeCl3溶液 | 10ml 2%H2O2 |
| 甲组实验Ⅱ | 探究浓度对速率的影响 | 25 | 10ml 5%H2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
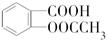 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下: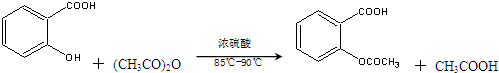
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 易水解 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 难溶电解质的Ksp越小,溶解度就一定越小 | |
| B. | 向含AgCl沉淀的悬浊液中加入NaCl饱和溶液,AgCl的溶解度变小,溶度积常数变小 | |
| C. | 用饱和Na2CO3溶液可以将BaSO4转化为BaCO3,说明Ksp(BaCO3)小于Ksp(BaSO4) | |
| D. | 一般认为沉淀离子浓度小于1.0×10-5 mol/L时,离子就已沉淀完全 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 再滴加AgNO3溶液,观察是否有AgI沉淀产生 | |
| B. | 加入CC14振荡后,观察下层液体颜色 | |
| C. | 加入CC14振荡后,取上层清液,滴加AgNO3溶液,观察是否有AgCl沉淀产生 | |
| D. | 加入CC14振荡后,取上层清液,滴加KSCN溶液,观察是否有血红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分散系中分散质粒子的大小:Fe(OH)3悬浊液<Fe(OH)3胶体<FeCl3溶液 | |
| B. | 焰色反应是物质燃烧时火焰呈现的颜色变化,属于化学变化 | |
| C. | 生石灰用作食品抗氧剂 | |
| D. | “海水淡化”可以解决“淡水供应危机”,但加入明矾不能使海水淡化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
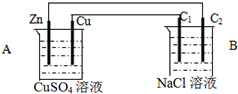 按如图装置进行实验,C1与C2均为石墨棒,回答下列问题
按如图装置进行实验,C1与C2均为石墨棒,回答下列问题 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com