
| A. | 青铜的熔点比纯铜和锡都高 | B. | 陶瓷的主要成分为硅酸盐 | ||
| C. | 古代的纸张主要成分为蛋白质 | D. | 黑火药爆炸时,氧化剂只有硝酸钾 |
分析 A.合金的熔点低于其中任意一种单质的熔点;
B.陶瓷是由陶土在高温下烧制的;
C.纸张是由植物纤维制造的;
D.黑火药爆炸时的反应为:S+2KNO3+3C═K2S+N2↑+3CO2↑,根据化合价变化分析.
解答 解:A.合金的熔点低于其中任意一种单质的熔点,所以青铜的熔点比纯铜和锡都低,故A错误;
B.陶瓷是由陶土在高温下烧制的,陶土的主要成分是硅酸盐,即陶瓷的主要成分为硅酸盐,故B正确;
C.纸张是由植物纤维制造的,所以古代的纸张主要成分为纤维素,不是蛋白质,故C错误;
D.反应2KNO3+3C+S═K2S+N2↑+3CO2↑中,N和S元素化合价降低,得电子,被还原,S和KNO3为氧化剂,故D错误.
故选B.
点评 本题考查了合金的性质、硅酸盐材料、氧化还原反应等,题目难度不大,侧重于基础知识的考查,注意从化合价的变化的角度分析氧化还原反应.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 给试管中的铜与浓硫酸加热,发现试管底部有白色固体并夹杂有少量黑色物质,此白色固体为硫酸铜,黑色固体为氧化铜 | |
| B. | SO2通入足量的Fe(NO3)3稀溶液中,溶液有棕黄色变为浅绿色,但立即又变成棕黄色,说明氧化性:HNO3>稀硫酸>Fe3+ | |
| C. | 配制一定物质的量浓度溶液时发现浓度偏低,可能由于配制溶液所用的容量瓶事先未干燥 | |
| D. | 浓硝酸在光照条件下变黄,说明浓硝酸不稳定,生成的有色产物能溶于浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
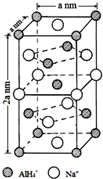 氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15,.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示.
氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15,.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示. .
. (标明配位键).
(标明配位键).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合物中含有0.05molFe元素 | |
| B. | 该硝酸溶液中溶质的质量分数是63% | |
| C. | 所加入NaOH溶液的体积最少是450mL | |
| D. | 反应中HNO3被氧化,生成氧化产物NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 实验目的 | |
| A | 将潮湿的NH3通过盛有无水CaCl2的干燥管 | 除去NH3中的水蒸气 |
| B | 往铁和稀硝酸反应后的溶液中滴入KSCN溶液 | 验证溶液中是否含有Fe3+ |
| C | 甲基橙作指示剂,用标准NaOH溶液滴定盐酸至红色 | 测量盐酸物质的量浓度 |
| D | 向2ml0.2mol/L的AgNO3溶液中先后滴加0.2mol/L 的NaCl溶液、KBr溶液各5滴 | 确定AgCl、AgBr的Kap的相对大小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 离子 | Cu2+ | Al3+ | NO3- | Cl- |
| 物质的量浓度(mol/L) | 1 | 1 | a | 1 |
| A. | 阳极生成1.5mol Cl2 | B. | a=3 | ||
| C. | 电解后溶液中c(H+)=1moL/L | D. | 阴极析出的金属是铜与铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.0 g D218O中含有的质子数为NA | |
| B. | 标准状况下,22.4 L NH3分子含有的杂化轨道数为4 NA | |
| C. | 78 g Na2O2晶体中所含阴、阳离子个数均为2 NA | |
| D. | 1 mol Fe完全溶于一定量的硝酸溶液中,转移的电子数一定是3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠在空气和氯气中燃烧,火焰皆呈黄色,但生成固体颜色不同 | |
| B. | 新制饱和氯水和浓硝酸光照下会有气体产生,其成分中有氧气 | |
| C. | 次氯酸和过氧化钠都能使品红溶液褪色,其原理是不相同的 | |
| D. | 灼烧NaOH固体时不能使用瓷坩埚,因为坩埚中的SiO2能与NaOH反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com