
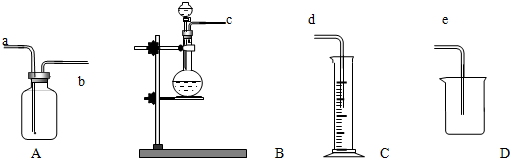
分析 (1)①氨气的密度比空气的密度小,应利用向下排空气收集;
②若将A装置进行排水法集气,应将水排出,导管短进;可收集不溶于水的气体;
(2)利用微溶法检验气密性;
(3)测定某活泼金属(以Na为例)的相对原子质量的实验装置,利用B装置发生钠与水的反应,A、C装置排水测定氢气的体积,即可计算测定.
解答 解:(1)①氨气的密度比空气的密度小,应利用向下排空气收集,则气体从b进口进入,故答案为:b;
②若将A装置进行排水法集气,应将水排出,导管短进,则气体从b进入;可收集不溶于水的气体,有H2、NO,故答案为:b;H2、NO;
(2)实验室检查B装置气密性的操作方法是将c连接的导管放入盛放水的水槽中,加热烧瓶,观察到水槽中有气泡冒出,则气密性良好,
故答案为:将c连接的导管放入盛放水的水槽中,加热烧瓶,观察到水槽中有气泡冒出,则气密性良好;
(3)测定某活泼金属(以Na为例)的相对原子质量的实验装置,利用B装置发生钠与水的反应,A、C装置排水测定氢气的体积,即可计算测定,则各导管接口的连接顺序为c→b→a→d,故答案为:c→b→a→d.
点评 本题考查实验装置综合,为高频考点,把握物质的性质、气密性检验、气体的收集、实验装置的作用为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2+3H2?CH3OH+H2O,该反应的能量变化如图所示:
目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2+3H2?CH3OH+H2O,该反应的能量变化如图所示:| t/min | 0 | 2 | 5 | 10 | 15 |
| n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 mol H2和1 mol N2 | |
| B. | 2 mol NH3和1 mol N2 | |
| C. | 2 mol N2和3 mol H2 | |
| D. | 0.1 mol NH3、0.9 mol N2、2.85 mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X能与某些非金属元素化合 | |
| B. | X可能为金属元素 | |
| C. | X原子的最外层电子数和核电荷数肯定为奇数 | |
| D. | X可能形成化学式为KXO3的盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将点燃的镁条伸入充满CO2气体的集气瓶中:2Mg+CO2═点燃 2MgO+C | |
| B. | 大理石溶于醋酸:CO32-+2CH3COOH═2CH3COO-+CO2↑+H2O | |
| C. | 向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至SO42-刚好沉淀完全:Ba2++2OH-+NH4++H++SO42-═BaSO4↓+NH3•H2O+H2O | |
| D. | 向淀粉KI溶液中滴加稀硫酸,在空气中放置一段时间后溶液变蓝:4H++4I-+O2═2I2+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com