
����Ŀ���Ҷ����׳Ʋ���![]() �ṹ��ʽΪ
�ṹ��ʽΪ![]() ���ɼ�дΪ
���ɼ�дΪ![]() ������һ����Ҫ�Ļ���ԭ�ϣ�
������һ����Ҫ�Ļ���ԭ�ϣ�![]() ������
������![]() ��
��![]() ��
��![]() ��
��![]() ��Һ��pH�����ʾ��
��Һ��pH�����ʾ��![]()
|
|
| |
pH |
|
|
|
��գ�
![]() �
д��![]() �ĵ��뷽��ʽ______��
�ĵ��뷽��ʽ______��
![]() ��Һ�����Ե�ԭ����______����
��Һ�����Ե�ԭ����______����![]() �IJ��������Һ��μ�NaOH��Һ�����ԣ���ʱ��Һ�������Ũ�ȹ�ϵ��ȷ����______��
�IJ��������Һ��μ�NaOH��Һ�����ԣ���ʱ��Һ�������Ũ�ȹ�ϵ��ȷ����______��
a.![]()
![]()
![]()
![]()
![]() �����Ը��������Һ��Ӧ��������������
�����Ը��������Һ��Ӧ��������������![]() ��������ɫ��ʧ��д����Ӧ�����ӷ���ʽ______����֪�÷�Ӧ��ʼʱ���ʽ����������ӿ죬���ܵ�ԭ����______��
��������ɫ��ʧ��д����Ӧ�����ӷ���ʽ______����֪�÷�Ӧ��ʼʱ���ʽ����������ӿ죬���ܵ�ԭ����______��
![]() ijͬѧ���ʵ����ͼ��ʾ�������ձ��е��Թܶ��ֱ�ʢ��2mL
ijͬѧ���ʵ����ͼ��ʾ�������ձ��е��Թܶ��ֱ�ʢ��2mL![]()
![]()
![]() ��Һ��4mL
��Һ��4mL![]() ����
����![]() ��Һ���ֱ��ϲ�����¼��Һ��ɫ����ʱ�䣮��ʵ��Ŀ�����о�______������ʵ��ʼ��û�п�����Һ��ɫ���Ʋ�ԭ��______��
��Һ���ֱ��ϲ�����¼��Һ��ɫ����ʱ�䣮��ʵ��Ŀ�����о�______������ʵ��ʼ��û�п�����Һ��ɫ���Ʋ�ԭ��______��
![]() ��֪����
��֪����![]() ���ȷֽ�Ļ�ѧ����ʽΪ��
���ȷֽ�Ļ�ѧ����ʽΪ��![]() ��д��
��д��![]() ���ܱ������и��·ֽ�Ļ�ѧ����ʽ______��
���ܱ������и��·ֽ�Ļ�ѧ����ʽ______��
���𰸡�![]() ��
��![]()
![]() �ĵ���̶ȴ���ˮ��̶� ad
�ĵ���̶ȴ���ˮ��̶� ad ![]() ��Ӧ���ɵ�
��Ӧ���ɵ�![]() �Ը÷�Ӧ���д����� �¶ȶԷ�Ӧ���ʵ�Ӱ��
�Ը÷�Ӧ���д����� �¶ȶԷ�Ӧ���ʵ�Ӱ�� ![]() ��Һ����
��Һ���� 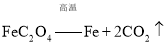
��������
![]() ������
������![]() ��
��![]() Ϊ
Ϊ![]() ��
��![]() ��pHΪ
��pHΪ![]() ��˵�������Ƕ�Ԫ���
��˵�������Ƕ�Ԫ���
![]() ���ܹ�����Ҳ�ܹ�ˮ�⣬
���ܹ�����Ҳ�ܹ�ˮ�⣬![]() ��Һ�����ԣ�˵��
��Һ�����ԣ�˵��![]() �ĵ���̶ȴ���ˮ��̶ȣ�
�ĵ���̶ȴ���ˮ��̶ȣ�
![]() ���������غ��жϣ�
���������غ��жϣ�
![]() ���ݵ���غ��жϣ�
���ݵ���غ��жϣ�
![]() ���������غ㡢����غ��жϣ�
���������غ㡢����غ��жϣ�
![]() ��ǡ�÷�Ӧ��
��ǡ�÷�Ӧ��![]() ����ʱ��Һ�ʼ��ԣ��ʼ�����������Ƶ����ʵ�������Щ��
����ʱ��Һ�ʼ��ԣ��ʼ�����������Ƶ����ʵ�������Щ��
![]() ������������Һ��Ӧ��������Һ�з���������ԭ��Ӧ�����ᱻ����Ϊ������̼��������ر���ԭΪ�����ӣ���Ӧ��ʼʱ���ʽ����������ӿ죬˵�����ɵ�
������������Һ��Ӧ��������Һ�з���������ԭ��Ӧ�����ᱻ����Ϊ������̼��������ر���ԭΪ�����ӣ���Ӧ��ʼʱ���ʽ����������ӿ죬˵�����ɵ�![]() �Ը÷�Ӧ���д����ã�
�Ը÷�Ӧ���д����ã�
![]() ���ձ���ˮ���¶Ȳ�ͬ����ʵ�����о��¶ȶԷ�Ӧ���ʵ�Ӱ�죻�����������ط�Ӧ�����ʵ���֮��Ϊ5��2���ݴ˷�����
���ձ���ˮ���¶Ȳ�ͬ����ʵ�����о��¶ȶԷ�Ӧ���ʵ�Ӱ�죻�����������ط�Ӧ�����ʵ���֮��Ϊ5��2���ݴ˷�����
![]() ��֪����
��֪����![]() ���ȷֽ�Ļ�ѧ����ʽΪ��
���ȷֽ�Ļ�ѧ����ʽΪ��![]() ������ֽ��ܹ�����CO��CO���л�ԭ�ԣ��ܹ���ԭFeO��
������ֽ��ܹ�����CO��CO���л�ԭ�ԣ��ܹ���ԭFeO��
![]() ��Ԫ����ֲ����룬������뷽��ʽΪ��
��Ԫ����ֲ����룬������뷽��ʽΪ��![]() ��
��![]() ��
��
�ʴ�Ϊ��![]() ��
��![]() ��
��
![]() ���ܹ�����Ҳ�ܹ�ˮ�⣬
���ܹ�����Ҳ�ܹ�ˮ�⣬![]() ��Һ�����ԣ�˵��
��Һ�����ԣ�˵��![]() �ĵ���̶ȴ���ˮ��̶ȣ�
�ĵ���̶ȴ���ˮ��̶ȣ�
![]() ̼Ԫ������Һ�д�����ʽ�У�
̼Ԫ������Һ�д�����ʽ�У�![]() ��
��![]() ��
��![]() �����������غ���
�����������غ���![]() ����a��ȷ��
����a��ȷ��
![]() ���ݵ���غ��У�
���ݵ���غ��У�![]() ����Һ�����ԣ���
����Һ�����ԣ���![]() ����
����![]() ����b����
����b����
![]() ��
��![]() ��
��![]() ��֪��
��֪��![]() ����c����
����c����
![]() ��ǡ�÷�Ӧ��
��ǡ�÷�Ӧ��![]() ����ʱ��Һ�ʼ��ԣ��ʼ�����������Ƶ����ʵ�������Щ����
����ʱ��Һ�ʼ��ԣ��ʼ�����������Ƶ����ʵ�������Щ����![]() ����d��ȷ��
����d��ȷ��
�ʴ�Ϊ��![]() �ĵ���̶ȴ���ˮ��̶ȣ�ad��
�ĵ���̶ȴ���ˮ��̶ȣ�ad��
![]() ������������Һ��Ӧ��������Һ�з���������ԭ��Ӧ�����ᱻ����Ϊ������̼��������ر���ԭΪ�����ӣ���Ӧ�����ӷ���ʽΪ��
������������Һ��Ӧ��������Һ�з���������ԭ��Ӧ�����ᱻ����Ϊ������̼��������ر���ԭΪ�����ӣ���Ӧ�����ӷ���ʽΪ��![]() ����Ӧ��ʼʱ���ʽ����������ӿ죬˵�����ɵ�
����Ӧ��ʼʱ���ʽ����������ӿ죬˵�����ɵ�![]() �Ը÷�Ӧ���д����ã�
�Ը÷�Ӧ���д����ã�
�ʴ�Ϊ��![]() ����Ӧ���ɵ�
����Ӧ���ɵ�![]() �Ը÷�Ӧ���д����ã�
�Ը÷�Ӧ���д����ã�
![]() ���ձ���ˮ���¶Ȳ�ͬ����ʵ�����о��¶ȶԷ�Ӧ���ʵ�Ӱ�죻�����������ط�Ӧ�����ʵ���֮��Ϊ5��2���Թ��в��������������ʵ���֮��Ϊ1��2��������ع�����������ȫ��Ӧ�����Բ���ɫ��
���ձ���ˮ���¶Ȳ�ͬ����ʵ�����о��¶ȶԷ�Ӧ���ʵ�Ӱ�죻�����������ط�Ӧ�����ʵ���֮��Ϊ5��2���Թ��в��������������ʵ���֮��Ϊ1��2��������ع�����������ȫ��Ӧ�����Բ���ɫ��
�ʴ�Ϊ���¶ȶԷ�Ӧ���ʵ�Ӱ�죻![]() ��Һ������
��Һ������
![]() ��֪����
��֪����![]() ���ȷֽ�Ļ�ѧ����ʽΪ��
���ȷֽ�Ļ�ѧ����ʽΪ��![]() ��������������ȷֽ�Ļ�ѧ����ʽΪ
��������������ȷֽ�Ļ�ѧ����ʽΪ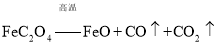 ��CO�ܹ���ԭFeO��
��CO�ܹ���ԭFeO��![]()
![]()
![]() �������䷴Ӧ����ʽΪ��
�������䷴Ӧ����ʽΪ��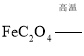
![]() ��
��
�ʴ�Ϊ��
![]()


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25 ��ʱ��ˮ�ĵ���ﵽƽ�⣺H2O![]() H����OH����H��0������������ȷ���ǣ� ��
H����OH����H��0������������ȷ���ǣ� ��
A.��ˮ�м���ϡ��ˮ��ƽ�������ƶ���c��OH��������
B.��ˮ�м��������������������ƣ�c��H��������ˮ�ĵ���̶�����
C.��ˮ�������c��H+��=1��10��12mol/L����ҺpHһ��Ϊ12
D.��ˮ���ȣ�Kw����pH��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С��������װ�ý����Ҵ���������ʵ�顣

(1)��д��װ��ͭ�����Թ��з�Ӧ�Ļ�ѧ����ʽ��___��
(2)���Ϲ��������Ϩ��ƾ��ƣ���Ӧ���ܼ������У�˵�����Ҵ���������Ӧ��____��Ӧ(��������������������)��
(3)��������ˮԡ���ò���ͬ����������___���ҵ�������___��
(4)��Ӧ����һ��ʱ�����ƿ�ռ�����������Ҫ��___��
(5)���Թ�a���ռ�����Һ������ɫʯ����ֽ���飬��ֽ�Ժ�ɫ��Ҫ��ȥ�����ʣ�ѡ����Լ���__(��д��ĸ)��
a.�Ȼ�����Һ b.�� c.̼��������Һ d.������
��ͨ��___(��ʵ���������)���ɵõ���ȩ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѡ����ȷ����![]()
A.ʹPH��ֽ��ɺ�ɫ����Һ�����ܴ��ڴ����ģ�![]() ��
��![]() ��
��![]() ��
��![]()
B.![]() ��Һ�У����ܴ��ڴ����ģ�
��Һ�У����ܴ��ڴ����ģ�![]() ��
��![]() ��
��![]() ��
��![]()
C.�����ữ�ĵ���KI��Һ�ڿ����б����ɫ��![]()
D.![]() ��Һ�еμ���������ʯ��ˮ��
��Һ�еμ���������ʯ��ˮ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��˫�ǻ���̼������ҽ���ϳ��õ�һ����������仯ѧʽ��NaAl��OH��2CO![]() �����ڸ����ʵ�˵����ȷ���ǣ� ��
�����ڸ����ʵ�˵����ȷ���ǣ� ��
A. ����������������������
B. ��������Al��OH��3��Na2CO3�Ļ����
C. 1 mol NaAl��OH��2CO3��������3 mol H![]()
D. ��ҩ�����ʺ���θ�����߷���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ���Ϊ21������߷�չDZ���������Դ��
(1)ˮ����ȡH2�ij���ԭ�ϣ������й�ˮ��˵����ȷ����______��
a.ˮ������һ�ּ��Է��ӣ�ˮ���ӿռ�ṹ��ֱ����
b.1��H2O��������2����s�����sp3�ӻ�����γɵ�����
c.ˮ���Ӽ�ͨ��H��O���γɱ�����
d.��������ˮ���ӵĿռ����з�ʽ��ɱ���������
(2)�����İ�ȫ���������������Ӧ�õĹؼ���
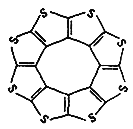
��������³�Ƚ���ѧ�о����Ľ���ADF������һ�����ͻ�ϩ�ഢ�����(C16S8)�����о��������۽Ƕ�֤�����ַ����е�ԭ�Ӷ�����ͬһƽ����(��ͼ1��ʾ)��ÿ��ƽ�������������ɴ�10��H2���ӣ�������Cԭ�ӵ��ӻ��������Ϊ______��C16S8������������֮��Ϊ______��C16S8��H2�������������______��
�ڰ����黯����(NH3BH3)��������й�ע��һ�����ͻ�ѧ�⻯�ﴢ����ϣ��뻭��������λ��������������ʾ���İ�����Ľṹʽ_____���백���黥Ϊ�ȵ�������л�С������___(д�ṹ��ʽ)��
��ij�־��д���ܵ�ͭ�Ͻ�������������ܶѻ��Ľṹ��������Cuԭ�Ӵ������ģ�Auԭ�Ӵ��ڶ���λ�ã���ԭ�ӿɽ��˵���Cuԭ����Auԭ�ӹ��ɵ��������϶�У�����Cuԭ����Auԭ�ӵ�ͬ�������þ��崢���ľ����ṹ��CaF2(�����ṹ��ͼ)�Ľṹ���ƣ��þ��崢���Cu��Au��HΪ______��
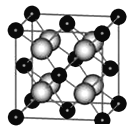
��MgH2�ǽ����⻯�ﴢ����ϣ��侧����ͼ��ʾ����֪�þ�����ܶ�ag��cm-3���������Ϊ______________cm3(�ú�a��NA�Ĵ���ʽ��ʾ��NA��ʾ����٤������)��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.������100gNa2O2��CO2��Ӧ�������������105.6g���˷�Ӧת�Ƶ���Ϊ0.4mol
B.��Fe�뺬nmolHNO3��ϡ��Һ��Ӧ�У�����ԭ��HNO3��һ��Ϊ![]() nmol
nmol
C.��Mg��Al���缫��������Һ������ʹ���ԭ����У�Mgһ��Ϊ����
D.����������һ��Ϊ������������������ﲻһ���Ƿǽ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬѧ������ͼ��ʾװ����ʵ�����Ʊ���������
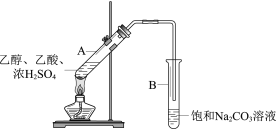
��1��ʵ���б���Na2CO3��Һ��������__________��
��2��������Թ�B����״Һ���õ�����Ҫ������_________________��
��3���Ҵ������ᷴӦ�����������ǿ��淴Ӧ������ݻ�ѧƽ���ƶ������֪ʶд��һ�����������������ʵķ���_________________��
��4����ҵ����CH2=CH2������ֱ�ӷ�Ӧ�����������
���䷴Ӧ������____��
����ʵ�����Ʒ���ȣ���ҵ�Ʒ����ŵ���_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.1mol�л�������A���״����5.6L������ϣ�һ��������������ȫ��Ӧ��ֻ��CO��CO2��H2O���ֲ����ȫ����������ͨ��������Ũ����ͼ�ʯ���У�Ũ��������5.4�ˣ���ʯ������4.4�ˣ����б�״����2.24L�����ʣ�࣬��
��1���л�������A�ķ���ʽ_______��Ҫ��д���������̣���
��2�����л�������A�����Ʒ�Ӧ�ų���������д��A�Ľṹ��ʽ_________��
��3��д�����б�A��һ����CH2��ԭ���ŵ�ͬϵ��Ľṹ��ʽ_________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com