
| A. | 热稳定性:HF<HCl<HBr<HI | B. | 微粒半径:Na+>Mg2+>Al3+ | ||
| C. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 | D. | 还原性:Na<Mg<Al |
分析 A.元素的非金属性越强,其氢化物的稳定性越强;
B.电子层结构相同的离子,离子半径随着原子序数增大而减小;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
D.元素的金属性越强,其单质的还原性越强.
解答 解:A.元素的非金属性越强,其氢化物的稳定性越强,非金属性F>Cl>Br>I,所以氢化物的稳定性HF>HCl>HBr>HI,故A错误;
B.电子层结构相同的离子,离子半径随着原子序数增大而减小,原子序数Na<Mg<Al,所以微粒半径:Na+>Mg2+>Al3+,故B正确;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性Cl>S>P>Si,所以酸性:HClO4>H2SO4>H3PO4>H2SiO3,故C正确;
D.元素的金属性越强,其单质的还原性越强,金属性Na>Mg>Al,所以还原性Na>Mg>Al,故D错误;
故选AD.
点评 本题考查元素周期律,为高频考点,侧重考查学生分析判断及规律的应用,明确元素周期律中金属性、非金属性强弱判断方法是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H5OH在电池的负极上参加反应 | |
| B. | 1 mol乙醇被氧化转移6 mol电子 | |
| C. | 在外电路中电子由负极沿导线流向正极 | |
| D. | 电池正极得电子的物质是O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 我国首创的海洋电池以铝板、铂网为电极,以海水作为电解质溶液,电池总反应为:4Al+3O2+6H2O=4Al(OH)3,下列有关该电池说法正确的是( )
我国首创的海洋电池以铝板、铂网为电极,以海水作为电解质溶液,电池总反应为:4Al+3O2+6H2O=4Al(OH)3,下列有关该电池说法正确的是( )| A. | 该电池工作时将电能转化为化学能 | |
| B. | 通常一段时间后该电池只需更换铝板就可继续使用 | |
| C. | 负极反应式是:O2+2H2O+4e-=4OH- | |
| D. | 铝片发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
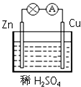
| A. | H2-2e-═2H+ | B. | Cu-2e-═Cu2+ | C. | 2H++2e-═H2↑ | D. | Zn-2e-═Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
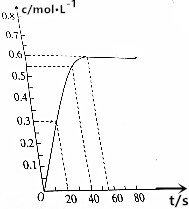 298K时,在2L的恒容密闭容器中,发生可逆反应:2NO2(g)?N2O4(g).N2O4的物质的量浓度随时间的变化如图.达到平衡时N2O4的浓度为NO2的2倍.
298K时,在2L的恒容密闭容器中,发生可逆反应:2NO2(g)?N2O4(g).N2O4的物质的量浓度随时间的变化如图.达到平衡时N2O4的浓度为NO2的2倍.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 |
| A | 加热放在坩埚中的小块钠 | 钠先熔化成光亮的小球,燃烧时火焰为黄色,燃烧后生成淡黄色固体 |
| B | 在酒精灯上加热铝箔 | 铝箔熔化,失去光泽,熔化的铝滴落下来 |
| C | 向久置于空气中的FeSO4溶液中滴加NaOH溶液 | 立刻产生大量白色沉淀 |
| D | 向饱和Na2CO3溶液中通入足量的CO2气体 | 无明显现象 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com