
【题目】下列各组离子在指定的溶液中能大量共存的是 ( )
①无色溶液中:K+、Cu2+、Na+、SO42-
②pH=11的溶液中:K+、Ba2+、Cl-、HCO3-
③能使酚酞试剂变红的溶液中:Cl-、CO32-、NO3-、NH4+
A.①B.②
C.③D.全都不行
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】如图是实验室进行二氧化硫制备与性质实验的组合装置,部分固定装置未画出。下列有关说法正确的是

A. 关闭 K2,打开 K1,滴加硫酸,则装置 B 中每消耗 1molNa2O2,转移电子数为NA
B. 关闭 K1,打开 K2,试剂 X 是酸性 KMnO4 或 FeCl3 溶液,均可证明 SO2 有还原性
C. 为防止环境污染,装置C和E中的试剂均取用饱和的石灰水
D. 实验过程中体现了硫酸的酸性、吸水性、难挥发性、强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z在周期表中的相对位置如图所示,其中Z的最外层电子数等于其最内层电子数。下列说法正确的是

A. 简单离子的半径:Z>Y>X
B. WX 与ZX中的化学键类型相同
C. 元素的非金属性:Y>X>W
D. Y的氢化物的水溶液可使红色石蕊试纸变蓝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、CO2是化石燃料燃烧的主要产物。
(1)将含0.02mol CO2和0.01 mol CO的混合气体通入有足量Na2O2固体的密闭容器中,同时不断地用电火花点燃,充分反应后,固体质量增加_____g。
(2)已知:2CO(g)+O2(g)==2CO2(g) △H=-566.0kJ/mol,键能Eo-o=499.0kJ/mol。则反应:CO(g)+O2(g)![]() CO2(g)+O(g)的△H=_________kJ/mol。
CO2(g)+O(g)的△H=_________kJ/mol。
(3)在某密闭容器中发生反应:2CO2(g)![]() 2CO(g)+O2(g),1molCO2在不同温度下的平衡分解量如图所示。
2CO(g)+O2(g),1molCO2在不同温度下的平衡分解量如图所示。

①恒温恒容条件下,能表示该可逆反应达到平衡状态的有___(填字母)。
A.CO的体积分数保持不变 B.容器内混合气体的密度保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.单位时间内,消耗CO的浓度等于生成CO2的浓度
②分析上图,若1500℃时反应达到平衡状态,且容器体积为1L,则此时反应的平衡常数K=___(计算结果保留1位小数)。
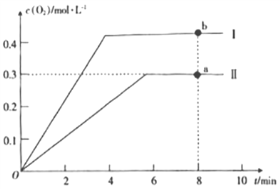
③向2L的恒容密闭容器中充入2molCO2(g),发生反应: 2CO2(g)![]() 2CO(g)+O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II所示。图中曲线I表示相对于曲线II仅改变一种反应条件后,c(O2)随时间的变化,则改变的条件是____;a、b两点用CO浓度变化表示的净反应速率关系为va(CO)____(填“>”“<”或“=”)vb(CO)。
2CO(g)+O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II所示。图中曲线I表示相对于曲线II仅改变一种反应条件后,c(O2)随时间的变化,则改变的条件是____;a、b两点用CO浓度变化表示的净反应速率关系为va(CO)____(填“>”“<”或“=”)vb(CO)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备BaCl2的工艺流程图如下: 
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验.查表得
BaSO4(s)+4C(s) ![]() 4CO(g)+BaS(s)△H1=+571.2kJmol﹣1①
4CO(g)+BaS(s)△H1=+571.2kJmol﹣1①
BaSO4(s)+2C(s) ![]() 2CO2(g)+BaS(s)△H2=+226.2kJmol﹣1②
2CO2(g)+BaS(s)△H2=+226.2kJmol﹣1②
(1)气体用过量NaOH溶液吸收,得到硫化钠.Na2S水解的离子方程式为 .
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时, ![]() = . [Ksp(AgBr)=5.4×10﹣13 , Ksp(AgCl)=2.0×10﹣10]
= . [Ksp(AgBr)=5.4×10﹣13 , Ksp(AgCl)=2.0×10﹣10]
(3)反应C(s)+CO2(g) ![]() 2CO(g)的△H2=kJmol﹣1 .
2CO(g)的△H2=kJmol﹣1 .
(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种固态烃的分子式为C12H12,经测定分子中无环状结构,由此推测该烃分子中最多含有碳碳双键的数目为( )
A. 6 B. 7 C. 10 D. 14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化石燃料开采、加工过程产生的H2S废气可以通过多种方法进行治理.可以制取氢气,同时回收硫单质,既廉价又环保。回答下列问题:
(1)已知:2H2(g)+O2(g)=2H2O(g) △H1
S(s)+ O2(g)=SO2(g) △H2
2S(s)![]() S2(g) △H3
S2(g) △H3
2H2S(g)+SO2(g)=3S(s)+2H2O(g) △H4
则反应2H2S(g)![]() 2H2(g)+ S2(g)的△H=_____
2H2(g)+ S2(g)的△H=_____
(2)工业上采州高温热分解HzS的方法制取H2,在膜反应器中分离出H2。
在恒容密闭容器中,阻H2S的起始浓度均为0.009 mol/L控制不同温度进行H2S分解:![]() ,实验过程中测得H2S的转化率如图所示。曲线a表示H2S的平衡转化率与温度的关系,曲线b表示不同温度F反应经过相同时间时H2S的转化率。
,实验过程中测得H2S的转化率如图所示。曲线a表示H2S的平衡转化率与温度的关系,曲线b表示不同温度F反应经过相同时间时H2S的转化率。

①在935℃时,该反应经过t s H2S的转化率达到P点数值,则在ts内用H2浓度变化表示的平均反应速率v(H2)=________。
②温度升高,平衡向____方向移动(填“正反应”“逆反应”),平衡常数____(填“增大”“减小”或“不变”)。985℃时该反应的平衡常数为________。
③随着H2S分解温度的升高,曲线b逐渐向曲线a靠近,其原因是___________。
(3)电解法治理硫化氢是先用FeCl3溶液吸收含H2S的工业废气,所得溶液用惰性电极电解,阳极区所得溶液循环利用。

①进入电解池的溶液中,溶质是____。
②阳极的电极反应式为________________。
③电解总反应的离子方程式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H 是合成抗炎药洛索洛芬钠的关键中间体,它的一种合成路线如下:
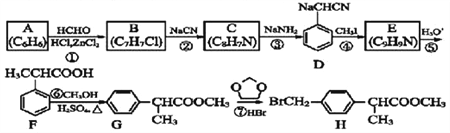
回答下列问题:
(1)质谱仪检测A的质谱图中,最大质荷比的数值是________。G中官能团名称是__________。
(2)B的结构简式为_________________________。
(3)反应②的反应类型为_________________________。反应④的化学方程式为____________。
(4)写出满足下列条件的F的同分异构体的结构简式:________________________。
I.能与FeCl3溶液发生显色反应
II.能发生银镜反应
III.核磁共振氢谱有4组峰且峰面积之比为6:2:1:1
(5)仿照H 的合成路线,设计一种由![]() 的合成路线______。
的合成路线______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com