
250℃和1.01×105 Pa时, 2N2O5(g) = 4NO2(g) + O2(g) △H= +56.76 kJ/mol,该反应能自发进行的原因是
A.是吸热反应 B.是放热反应
C.是熵减少的反应 D.熵增大效应大于焓效应
科目:高中化学 来源: 题型:
物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,当溶液的体积比为
3∶2∶1时,三种溶液中Cl物质的量浓度之比为 ( )
A. 1∶1∶1 B.1∶2∶3 C.3∶2∶1 D. 3∶4∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
下图曲线a表示放热反应X(g)+Y(g) Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
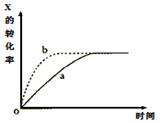
A.减小体积 B.加大X的投入量
C.减压 D.升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,某容积恒定的密闭容器中发生如下可逆反应
CO(g)+H2O(g) H2(g)+CO2(g) △H>0
H2(g)+CO2(g) △H>0
当反应达平衡时,测得容器中各物质均为nmol,欲使H2的平衡浓度增大一倍,在其它条件不变时,下列措施可以采用的是
A.升高温度 B.再加入2n mol H2
C.再加入nmol CO和nmol H2O D.再加入2n mol CO2和2n mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
H2S溶于水的电离方程式为 。
⑴向H2S溶液中加入浓盐酸时,电离平衡向 移动,c(H+) (填增大、减小、不变),c(S2-) (填增大、减小、不变)。
⑵向H2S溶液中加入NaOH固体,电离平衡向 移动,c(H+) (填增大、减小、不变),c(S2-) (填增大、减小、不变)。
⑶若要使H2S溶液中c(HS-)增大,且使H2S的电离平衡逆向移动,可以加入 。
⑷向H2S溶液中加水,c(HS-) (填增大、减小、不变),溶液pH (填增大、减小、不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质在水溶液状态下电离方程式错误的是
A.CaCO3 = Ca2++CO32— B.NaHSO4 = Na++HSO4—
C.H2CO3 H++HCO3— D.NH3·H2O
H++HCO3— D.NH3·H2O NH4++OH—
NH4++OH—
查看答案和解析>>
科目:高中化学 来源: 题型:
根据碘与氢气反应的热化学方程式
(Ⅰ)I2(g) + H2(g)  2 HI(g) ΔH=-9.48 kJ/mol
2 HI(g) ΔH=-9.48 kJ/mol
(Ⅱ)I2(s) + H2(g) 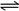 2 HI(g) ΔH=+26.48 kJ/mol
2 HI(g) ΔH=+26.48 kJ/mol
下列判断正确的是
A.254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应(Ⅰ)的产物比反应(Ⅱ)的产物稳定
D.反应(Ⅱ)的反应物总能量比反应(Ⅰ)的反应物总能量低
查看答案和解析>>
科目:高中化学 来源: 题型:
硝酸是一种重要的化工原料,工业上生产硝酸的主要过程如下。
(1)以N2和H2为原料合成氨气。反应:N2(g)+3H2(g) 2NH3(g) ΔH<0。
2NH3(g) ΔH<0。
①该反应的化学平衡常数表达式是K= 。
②该反应的化学平衡常数K与温度T的关系如下表所示:
| T / K | 473 | 573 | 673 | …… |
| K | 4.4×10-2 | K1 | K2 | …… |
其中,K1 K2(填“>”、“=”或“<”)。
③ 下列措施可以提高H2的转化率的是(填选项序号)____________________。
a.选择适当的催化剂
b.增大压强
c.及时分离生成的NH3
d.升高温度
④ 一定温度下,在密闭容器中充入1 mol N2和3 mol H2发生反应。
(Ⅰ)若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的 ,
,
求N2的转化率α1。(用三列式作答,要求写出计算过程)
(Ⅱ)若容器压强恒定,达到平衡状态时,N2的转化率为α2,则α2 α1(填“>”、“<”或“=”)。
(2)以氨气、空气为主要原料制硝酸。
① NH3被氧气催化氧化生成NO的反应的化学方程式是_________________。
② 在容积恒定的密闭容器中进行反应2NO(g)+O2(g) 2NO2(g) ΔH>0。该反应的反应速率(υ)随时间(t)变化的关系如图所示。若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)___________________。
2NO2(g) ΔH>0。该反应的反应速率(υ)随时间(t)变化的关系如图所示。若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)___________________。
 |
a.在t1 ~ t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施可以是升高温度
c.在t3 ~ t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t5时,容器内NO2的体积分数是整个过程中的最大值
(3)硝酸厂常用催化还原法处理尾气:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g) + O2(g)=2H2O(g) ΔH=— 483.6 kJ/mol
N2(g) + 2O2(g)=2NO2(g) ΔH=+ 67.7 kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是_____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关原电池的叙述中正确的是( )
A.把电能转变为化学能的装置
B.活泼金属做正极,不活泼金属或非金属做负极
C.外电路中电子从负极流向正极
D.正极发生氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com