
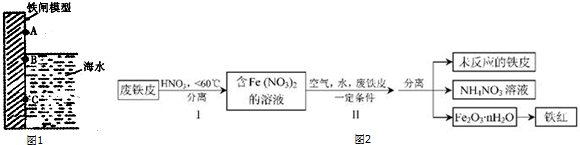
分析 (1)弱酸性或中性条件下钢铁发生吸氧腐蚀,强酸性条件下钢铁发生析氢腐蚀;含有氧气和水时钢铁极易被腐蚀;
(2)废铁片中加入稀硝酸,温度低于60℃,硝酸将铁氧化为亚铁离子,然后采用过滤方法分离,步骤Ⅱ中转化为Fe2O3•nH2O,最后得到铁红;
①酸性条件下,亚铁离子被硝酸根离子氧化生成铁离子;
②应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,则Fe与硝酸反应生成硝酸亚铁、硝酸铵和水;
(3)①亚铁离子能与铁氰化钾溶液反应生成蓝色沉淀,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色;
②二氧化硫具有还原性,在水溶液中能被溴氧化生成硫酸,硫酸和氯化钡反应生成硫酸钡沉淀,根据S原子守恒计算n(SO2),从而计算其体积分数.
解答 解:(1)①海水溶液呈中性,则钢铁发生吸氧腐蚀,钢铁接触空气、水时腐蚀生成亚铁,与空气接触部分最终生成铁锈,只有B符合,故答案为:B;
(2)废铁片中加入稀硝酸,温度低于60℃,硝酸将铁氧化为亚铁离子,然后采用过滤方法分离,步骤Ⅱ中转化为Fe2O3•nH2O,最后得到铁红;
①酸性条件下,亚铁离子被硝酸根离子氧化生成铁离子,离子反应方程式为3Fe2++4H++NO3-=3Fe2++NO↑+2H2O,
故答案为:3Fe2++4H++NO3-=3Fe2++NO↑+2H2O;
②产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,则Fe与硝酸反应生成硝酸亚铁、硝酸铵和水,该反应为4Fe+10HNO3═4Fe(NO3)2+NH4NO3+3H2O,
故答案为:4Fe+10HNO3═4Fe(NO3)2+NH4NO3+3H2O;
(3)①亚铁离子能与铁氰化钾溶液反应生成蓝色沉淀,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,所以可以用铁氰化钾、酸性高锰酸钾溶液检验亚铁离子,故选BD.
故答案为:BD;
②二氧化硫具有还原性,在水溶液中能被溴氧化生成硫酸,离子反应方程式为SO2+Br2+2H2O=4H++2Br-+SO42-,硫酸和氯化钡反应生成硫酸钡沉淀,n(BaSO4)=$\frac{2.33g}{233g/mol}$=0.01mol,根据S原子守恒得n(SO2)=n(BaSO4)=0.01mol,V(SO2)=0.01mol×22.4L/mol=224mL,二氧化硫体积分数=$\frac{224ml}{560ml}$=40%,
故答案为:SO2+Br2+2H2O=4H++2Br-+SO42-;40%.
点评 本题考查物质分离和提纯、物质制备、金属腐蚀与防护等知识点,明确物质性质、反应原理是解本题关键,注意除杂时要除去杂质且不能引进新的杂质,知道亚铁离子、铁离子检验方法及其现象,题目难度不大.


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:实验题
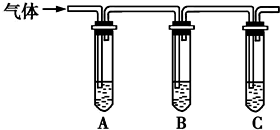 NaCl和NaClO在酸性条件下可发生反应:ClO-+Cl-+2H+═Cl2↑+H2O,某学习小组拟研究消毒液(主要成分为NaCl和NaClO)的变质情况.
NaCl和NaClO在酸性条件下可发生反应:ClO-+Cl-+2H+═Cl2↑+H2O,某学习小组拟研究消毒液(主要成分为NaCl和NaClO)的变质情况.| 所加试剂 | 预期现象和结论 |
| 向试管A中加足量①1.0mol/LK淀粉溶液; 试管B中加1%品红溶液; 试管C中加②澄清石灰水. | 若A中溶液变蓝色,B中溶液不褪色,C中溶液变浑浊,则消毒液部分变质; ③若A中溶液变蓝色,B中溶液不退色(无变化),C中溶液不变浑浊(无变化),则消毒液未变质,则消毒液未变质; ④若A中溶液不变蓝色(无变化),B中溶液不退色(无变化),C中溶液变浑浊则消毒液完全变质,则消毒液完全变质. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量浓度的下列溶液:①H2CO3 ②Na2CO3 ③NaHCO3 ④(NH4)2CO3其中c(CO32-)的大小关系为:②>④>③>① | |
| B. | pH=2的H2C2O4溶液与pH=12的NaOH溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c( HC2O4-)+c( C2O42-) | |
| C. | 向0.2 mol•L-1NaHCO3溶液中加入等体积0.1 mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,同浓度的CH3COONa与CH3COOH溶液等体积混合,溶液的pH<7:c(CH3COOH)+c(OH-)>c(Na+)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高压钠灯发出的黄光射程远.透雾能力强,常用于道路和广场的照明 | |
| B. | 镁合金密度小,硬度和强度大,可用于制造火箭、导弹和飞机的部件 | |
| C. | 水玻璃常用于浸泡有特殊用途的木材、纺织品等达到耐腐蚀和防火的目的 | |
| D. | 氢氧化铁胶体具有吸附性,能吸附水中的悬浮颗粒并沉降,可用作消毒剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
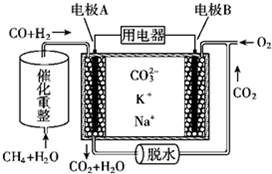
| A. | 电池工作时,K+向B极移动 | |
| B. | 电极B上发生的电极反应:O2+2CO2+4e-═2CO32- | |
| C. | 电池工作时,CO2可以循环利用 | |
| D. | 消耗1molCH4催化重整得到的CO和H2通入电极A,需要电极B同时通入33.6L的O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| … | E | A | B | ||
| C | … | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com