
| 组别 | c(一元酸) | c(NaOH)/mol•L-1 | 混合溶液的pH |
| 甲 | c(HX)=0.1mol•L-1 | 0.1 | pH=x |
| 乙 | c(HY)=0.1mol•L-1 | 0.1 | pH=7 |
| 丙 | c(HZ)=0.1mol•L-1 | 0.1 | pH=9 |

分析 (1)由表格中的数据可知,等体积等浓度混合,HY与NaOH反应后溶液的pH=7,则HY为强酸;pH=9,说明NaZ为强碱弱酸盐,HZ为弱酸,依据离子积常数计算得到水电离的氢氧根离子浓度;
(2)①0.1mol/L的酸溶液,图1表示的PH=1说明为强酸,图2起始溶液PH=3,说明为弱酸在溶液中部分电离出氢离子;
②图象中溶液PH=7时溶液呈中性,BD点时溶液显示中性,分析图①,图②可知图1是强酸强碱反应,反应终点时溶液PH=7,图2是弱酸和强碱反应,恰好反应生成的盐是强碱弱酸盐,溶液呈碱性;
(3)pH=3的盐酸的物质的量浓度=1×10-3 mol/L,中和相同物质的量的盐酸,碱的浓度越大,所用的碱越少,注意弱碱溶液中氢氧根离子的物质的量浓度和碱的浓度不等;
(4)从醋酸是弱电解质的角度分析,醋酸与Zn反应同时,电离出H+,pH变化较缓慢.
解答 解:(1)等体积等浓度混合,只有HY与NaOH反应后溶液的pH=7,则HY为强酸,pH=9,说明NaZ为强碱弱酸盐,HZ为弱酸,则HZ和NaOH发生反应的离子方程式为HZ+OH-═H2O+Z-,所得溶液中由水电离出的c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-9}}$=1×10-5mol/L,
故答案为:HY;HZ+OH-═H2O+Z-;1×10-5;
(2)①0.1mol/L的酸溶液,图1表示的PH=1说明为强酸,图2起始溶液PH=3,说明为弱酸在溶液中部分电离出氢离子,乙组酸碱等浓度等体积反应溶液PH=7说明溶液呈中性是强酸强碱发生的反应,图1符合,
故答案为:图1;
②图象中溶液PH=7时溶液呈中性,BD点时溶液显示中性,分析图①,图②可知图1是强酸强碱反应,反应终点时溶液PH=7,图2是弱酸和强碱反应,恰好反应生成的盐是强碱弱酸盐,溶液呈碱性,说明BE点是表示溶液恰好完全反应的点,
故答案为:BE;
(3)pH=3的盐酸的物质的量浓度=1×10-3 mol/L,①中氨水的物质的量浓度是1×10-3 mol/L,②一水合氨是弱电解质,只有部分电离,所以②中氨水的浓度大于1×10-3 mol/L,③中氢氧根离子的浓度是1×10-3 mol/L.
盐酸和氢氧化钡都是强电解质,氢离子和氢氧根离子中和时是1:1的关系,氢离子和氢氧根离子的浓度相等,所以a、d的体积相等,即a=d;
②的氨水浓度大于①的浓度,中和相同物质的量的盐酸,氨水的浓度越大,使用的氨水的体积越小,所以c<b.
盐酸和氨水反应生成的氯化铵是强酸弱碱盐,水解后使溶液呈酸性,要想使溶液呈中性,氨水的物质的量应稍微比盐酸的大些,当盐酸浓度和氨水的浓度相等时,氨水的体积b应大于盐酸的体积a,即溶液的体积a<b.
②③中氢氧根离子的浓度相等,一水合氨是一元弱电解质,氢氧化钡是强电解质,所以氨水的浓度大于③中氢氧根离子浓度,中和相同物质的量的氢离子时,②所用的氨水的体积小于③氢氧化钡溶液的体积,即c<d=a.
所以a、b、c、d的关系b>a=d>c,
故答案为:b>a=d>c;
(4)由于醋酸是弱电解质,与Zn反应同时,电离出H+,所以pH变化较缓慢,所以B曲线是醋酸溶液的pH变化曲线.由图知盐酸和醋酸的pH变化都是由2到4,盐酸中氢离子浓度逐渐减小,但醋酸中存在电离平衡,氢离子和锌反应时促进醋酸电离,补充反应的氢离子,所以醋酸是边反应边电离H+,故消耗的Zn多,所以m1<m2.
故答案为:B;<.
点评 本题考查酸碱混合后溶液的定性判断,注意表格中pH的应用是解答本题的关键,明确酸性的强弱及盐类水解的关系即可解答,题目难度中等.


科目:高中化学 来源: 题型:选择题
| 选 项 | 操 作 | 现 象 | 结 论 |
| A | 向无水乙醇中滴入酸性KMnO4溶液,充分振荡 | 紫红色褪去 | 乙醇有氧化性 |
| B | 向某溶液中滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中一定有SO42- |
| C | 向某无色溶液中滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| D | 向某溶液中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作 | 现象 | 结论 | |
| A | 滴加稀盐酸 | 有气泡产生 | 原溶液中有CO32- |
| B | 滴加盐酸酸化的BaCl2溶液 | 生成白色沉淀 | 原溶液中有Ag+或SO42- |
| C | 用洁净铂丝蘸取溶液进行灼烧 | 火焰呈黄色 | 原溶液中有Na+、无K+ |
| D | 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管 | 试纸不变蓝 | 原溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气可用于自来水消毒 | |
| B. | 40%的甲醛水溶液可用作防腐剂,浸制生物标本 | |
| C. | 工业酒精可用于酿造饮用酒 | |
| D. | 食盐中添加碘酸钾(KIO3)加工碘盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | 成分的质量(g) | 摩尔质量(g•mol-1) |
| 蔗糖 | 25.00 | 342 |
| 硫酸钾 | 0.87 | 174 |
| 阿司匹林 | 0.17 | 180 |
| 高锰酸钾 | 0.316 | 158 |
| 硝酸银 | 0.02 | 170 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
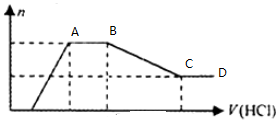
| A. | 溶液X中一定不含Cu2+、Mg2+、Al3+,可能含有Cl- | |
| B. | OA段参加反应的阴离子的物质的量之比为2:1或1:2 | |
| C. | AB段一定生成了气体 | |
| D. | BC段发生反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是用来描述物质所含微粒数目多少的基本物理量 | |
| B. | 1 mol氯约含有 6.02×1023个微粒 | |
| C. | 水的摩尔质量是它的相对分子质量 | |
| D. | 1 cm3铁所含有的铁原子数是$\frac{ρ•{N}_{A}}{56}$( ρ是铁的密度,单位为 g/cm3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com