
| A. | 向AlCl3溶液中滴加氨水,会产生白色沉淀,再加入NaHSO4,沉淀不消失 | |
| B. | 浓的NaOH溶液不慎溅到皮肤上,可无用大量水冲洗,再涂上硼酸或稀醋酸溶液 | |
| C. | AlCl3溶液中加入过量NaF固体,再滴加氨水,无沉淀产生说明[AlF6]3-很难电离 | |
| D. | 检验Cl-时,为了排除SO42-的干扰,可先滴加过量的Ba(NO3)2溶液后,取上层溶液,再滴加AgNO3溶液,若有白色沉淀,则表明原溶液中有Cl-存在 |
分析 A.氯化铝溶液中滴入氨水反应生成氢氧化铝沉淀,滴入NaHSO4溶液,溶液中电离出的氢离子溶液显酸性,氢氧化铝溶解;
B.氢氧化钠溶液是强碱,具有腐蚀性;
C.AlCl3溶液中加入过量NaF固体,生成[AlF6]3-;
D.先滴加过量的Ba(NO3)2溶液可排除SO32-、SO42-的干扰.
解答 解:A.向AlCl3溶液中滴加氨水,会产生白色沉淀,Al3++3NH3•H2O=Al(OH)3↓+3NH4+,再加入NaHSO4,溶液中电离出的氢离子显酸性,氢氧化铝溶解沉淀消失,Al(OH)3+3H+=Al3++3H2O,故A错误;
B.氢氧化钠溶液是强碱,具有腐蚀性,不慎洒在衣服上,用较多的水冲洗,再涂上硼酸或稀醋酸溶液,硼酸或稀醋酸是弱酸,腐蚀性小,故B正确;
C.AlCl3溶液中加入过量NaF固体,无氟离子和铝离子双水解生成的氢氧化铝沉淀,生成了明[AlF6]3-,无沉淀产生说明[AlF6]3-很难电离,故C正确;
D.先滴加过量的Ba(NO3)2溶液可排除SO32-、SO42-的干扰,滴加AgNO3溶液,若有白色沉淀,则表明原溶液中有Cl-存在,故D正确.
故选A.
点评 本题考查化学实验方案的评价,为高频考点,侧重物质的性质及离子的检验的考查,注意检验离子应排除干扰,注重基础知识的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
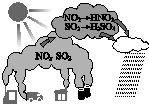
| A. | 汽车尾气是导致酸雨的原因之一 | B. | 酸雨会使土壤、湖泊酸化 | ||
| C. | 酸雨形成中不涉及氧化还原反应 | D. | 燃煤中加入石灰石可防治酸雨 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
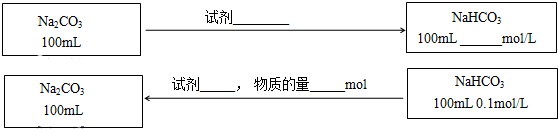
| 实验序号 | 实验操作 | 实验现象 |
| 实验1 | 向2mL 0.001mol/L NaHCO3溶液中加入1mL 0.1mol/LCaCl2溶液 | 无明显变化.用激光笔照射,没有出现光亮的通路. |
| 实验2 | 向2mL 0.1mol/L NaHCO3溶液中加入1mL 0.1mol/LCaCl2溶液 | 略显白色均匀的浑浊,用激光笔照射,出现光亮的通路. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
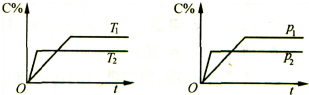
| A. | Tl>T2,△H<O | B. | Tl<T2,△H<O | C. | Pl>P2,a+b>c | D. | Pl<P2,a+b>c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Fe+4H2O═Fe2O3+4H2 | B. | 3NO2+H2O═2HNO3+NO | ||
| C. | Ca(OH)2+SO2═CaSO3+H2O | D. | Cu+2H2SO4(浓)═CuSO4+SO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 试管内壁附着的硫黄可以用热的KOH溶液洗涤,也可以用CS2洗涤 | |
| B. | 盛Na2SO3、Na2S溶液的试剂瓶不能用玻璃塞,贮存时应盖好瓶塞,防止被空气氧化 | |
| C. | 金属镁着火可使用扑救金属火灾的专用干粉灭火剂灭火,但不可用泡沫灭火器灭火 | |
| D. | 从硫酸亚铁铵溶液中获取硫酸亚铁铵晶体,可以用蒸发结晶,也可以用冷却结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、SO42-、Cl-、NO3- | B. | Na+、HCO3-、Ca2+、Cl- | ||
| C. | Na+、Cl-、NO3-、Fe3+ | D. | K+、Cl、CO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
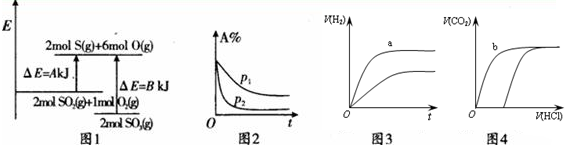
| A. | 图1表示化学反应2S02(g)+O2(g)?2S03(g)的能量变化,该反应的△H=A一BkJ/mol | |
| B. | 图2表示其他条件不变时,反应2A(g)+B(g)?c(g)+D(g)在不同压强下随时间的变化 | |
| C. | 图3表示体积和浓度均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液 | |
| D. | 图4表示100 ml O.1 mol•L-Na2C03和NaHC03两种溶液中,分别逐滴滴加0.1 mol•L-1HCl,产生CO2 的体积随盐酸体积的变化,则b表示NaHCO3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com