
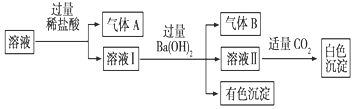
| A. | 气体A一定是CO2,气体B一定是NH3 | |
| B. | 白色沉淀一定是Al(OH)3 | |
| C. | 溶液中一定存在Al3+、Fe2+、NO3-、NH4+离子 | |
| D. | 溶液中一定不存在大量Na+离子 |
分析 溶液加入盐酸生成气体,可能含有CO32-,或为Fe2+、NO3-发生氧化还原反应生成NO,溶液Ⅰ加入过量氢氧化钡生成气体B,一定为氨气,则存在NH4+,有色沉淀为氢氧化铁,则含有Fe2+,可知不存在CO32-,溶液Ⅱ呈碱性,白色沉淀可能为氢氧化铝、碳酸钡等,不能确定,以此解答该题.
解答 解:溶液加入盐酸生成气体,可能含有CO32-,或为Fe2+、NO3-发生氧化还原反应生成NO,溶液Ⅰ加入过量氢氧化钡生成气体B,一定为氨气,则存在NH4+,有色沉淀为氢氧化铁,则含有Fe2+,可知不存在CO32-,溶液Ⅱ呈碱性,白色沉淀可能为氢氧化铝、碳酸钡等,不能确定,
A.由以上分析可知A为NO,故A错误;
B.溶液Ⅱ呈碱性,白色沉淀可能为氢氧化铝、碳酸钡等,故B错误;
C.不能确定是否含有Al3+,故C错误;
D.题中存在的各离子具有相同的物质的量,含有Fe2+、NH4+、NO3-、SO42-,不含Na+,故D正确.
故选D.
点评 本题考查了离子共存、常见离子的检验方法,题目难度中等,注意掌握常见离子的性质及检验方法,要求学生能够根据反应现象判断离子存在情况,试题培养了学生灵活应用所学知识的能力.


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KAl(SO4)2溶液:c(SO42-)>(K+)=c(Al3+ )>c(H+)>c(OH-) | |
| B. | NaHCO3溶液:c(Na+)+c(H+)=c(CO32-)+c(OH-)+c(HCO3-) | |
| C. | Na2S溶液:c(OH-)-(H+)=c(HS-)+c(H2S) | |
| D. | CH3COONa与 HCl混合后呈中性的溶液:c(Na+)>c(Cl-)=c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ②③④ | C. | ①②③ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

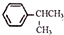 可写成
可写成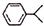
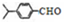 ,上述合成路线中①属于加成反应;
,上述合成路线中①属于加成反应;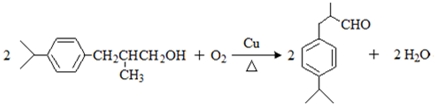 .
.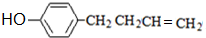 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | iPhone5外壳易掉色原因是,铝壳表面氧化处理过程中作为阳极的金属铝纯度不够 | |
| B. | 道尔顿、汤姆生、卢瑟福、玻尔等科学家的研究不断更新人们对原子结构的认识 | |
| C. | H2O2在过氧化氢酶的催化下,随着温度的升高,分解速率持续加快 | |
| D. | 古代的陶瓷、砖瓦,现代的普通玻璃、水泥都是硅酸盐产品 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0×10-3 mol•L-1盐酸的pH=3.0,1.0×10-7.5 mol•L-1盐酸的pH=7.5 | |
| B. | 在滴有酚酞溶液的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 | |
| C. | 在醋酸溶液的pH=a,将此溶液稀释10倍后,溶液的pH=b,则a>b | |
| D. | 若1mLpH=1的盐酸与100mLNaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Y | |||
| M | X | Z |
| A. | 钠与Z可能形成只含离子键的Na2Z、Na2Z2化合物 | |
| B. | X的最高价氧化物不与任何酸反应 | |
| C. | Y的最简单气态氢化物的热稳定性比X的强,因为Y的最简单气态氢化物分子间存在氢键 | |
| D. | M的简单离子半径是同周期中简单离子半径最小的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
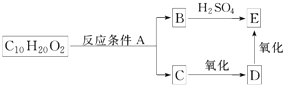
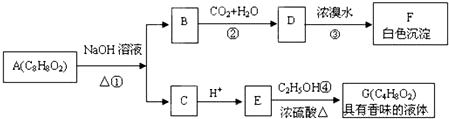
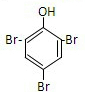 .
.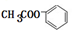 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$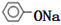 +CH3COONa+H2O.
+CH3COONa+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com