
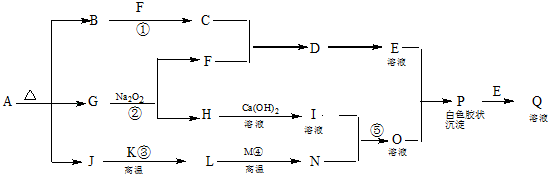
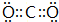 ;
;分析 A为常见的化肥,分解得到B、G、J,且B、J为10电子的分子,则A为碳酸铵或碳酸氢铵,B、J分别为NH3、H2O中的一种,G为CO2,与过氧化钠反应生成生成碳酸钠与氧气,而F能与B反应生成C,H与氢氧化钙溶液反应,则F为O2,H为Na2CO3,B为NH3,J为H2O,则C为NO、D为NO2、I为NaOH.K、M为常见金属单质,K与水反应生成L,L与M反应生成N,结合P为白色沉淀,可推知K为Fe、M为Al,则L为Fe3O4,N为Al2O3,O为NaAlO2,P为Al(OH)3,E为HNO3,Q为Al(NO3)3,据此解答.
解答 解:A为常见的化肥,分解得到B、G、J,且B、J为10电子的分子,则A为碳酸铵或碳酸氢铵,B、J分别为NH3、H2O中的一种,G为CO2,与过氧化钠反应生成生成碳酸钠与氧气,而F能与B反应生成C,H与氢氧化钙溶液反应,则F为O2,H为Na2CO3,B为NH3,J为H2O,则C为NO、D为NO2、I为NaOH.K、M为常见金属单质,K与水反应生成L,L与M反应生成N,结合P为白色沉淀,可推知K为Fe、M为Al,则L为Fe3O4,N为Al2O3,O为NaAlO2,P为Al(OH)3,E为HNO3,Q为Al(NO3)3.
(1)A的名称为碳酸铵或碳酸氢铵 G为CO2,电子式是 ,
,
故答案为:碳酸铵或碳酸氢铵;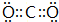 ;
;
(2)反应③的化学方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$ Fe3O4+4H2;反应⑤的离子方程式为:Al2O3+2OH-=2AlO2-+H2O,
故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$ Fe3O4+4H2;Al2O3+2OH-=2AlO2-+H2O;
(3)一定条件下,当NH3与O2按一定比例反应恰好生成只含一种溶质的溶液时,该溶质可能的化学式是HNO3 或NH4NO3;
若溶质为HNO3,根据电子转移守恒则:8n(NH3)=4n(O2),故n(NH3):n(O2)=1:2,由H原子守恒可知,n(HNO3):n(H2O)=1:1,故则n(HNO3)=n(H2O)=$\frac{mg}{(63g/mol+18g/mol)}$=$\frac{m}{81}$mol,则氨气的体积为$\frac{m}{81}$mol×22.4L/mol=$\frac{22.4m}{83}$L;
若溶质为NH4NO3,设其为1mol,根据N原子守恒可知n(NH3)=2mol,根据电子转移守恒则:8n(NH4NO3)=4n(O2),则n(O2)=2mol,故n(NH3):n(O2)=1:1,由H原子守恒可知n(H2O)=(2mol×3-1mol×4)÷2=1mol,故n(NH4NO3):n(H2O)=1:1,故则n(NH4NO3)=n(H2O)=$\frac{mg}{(80g/mol+18g/mol)}$=$\frac{m}{98}$mol,则氨气的体积为=$\frac{m}{98}$mol×2×22.4L/mol=$\frac{22.4m}{49}$L;
故答案为:HNO3 或NH4NO3;1:2(或1:1);$\frac{22.4m}{83}$(或$\frac{22.4m}{49}$).
点评 本题考查无机物的推断、化学计算等,注意利用A分解得到B、J为10电子物质为突破口,结合转化中特殊反应进行推断,需要学生熟练掌握元素化合物性质,(3)计算为易错点、难点,难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中:K+、Fe2+、Cl-、NO3- | |
| B. | 含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN- | |
| C. | pH=12的溶液中:K+、NH4+、SO42-、NO3- | |
| D. | 水电离产生的c(OH-)=1×10-14mol•L-1:K+、Na+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碱金属元素的单质及其化合物被广泛应用于生产、生活中.
碱金属元素的单质及其化合物被广泛应用于生产、生活中.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝片与稀H2SO4反应 | B. | Ba(OH)2•8H20与NH4CI的反应 | ||
| C. | 甲烷在02中的燃烧反应 | D. | 灼热的炭与C02反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | U元素的近似相对原子质量为235 | |
| B. | ${\;}_{92}^{235}$U中中子数比质子数多51 | |
| C. | ${\;}_{92}^{235}$U与${\;}_{6}^{12}$C的质量比约为235:12 | |
| D. | ${\;}_{92}^{235}$U 与${\;}_{92}^{238}$U属于同一种元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,CH3CH(C2H5)CH2CH(CH3)2的命名为:2-甲基-4-乙基戊烷 | |
| B. | 若两种二肽互为同分异构体,则二者的水解产物一定不相同 | |
| C. |  的单体是CH3-C=C-CH3和CH2=CH-CN 的单体是CH3-C=C-CH3和CH2=CH-CN | |
| D. | 已知 可使Br/CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳酸双键 可使Br/CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳酸双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com