
分析 (1)由HA-?H++A2-可知,Na2A为强碱弱酸盐;
(2)由HA-?H++A2-可知,Na2A为强碱弱酸盐;NaHA为酸式盐,H2A第一步完全电离,所以HA-只电离,不发生水解;
(3)HA-═H++A2-,Ka=$\frac{c({H}^{+})c({A}^{2-})}{c(H{A}^{-})}$;
(4)Kw=c(OH-)•c(H+)=KW=c2(OH-),中性溶液中存在c(OH-)=c(H+),NaHA溶液显酸性,某温度下,向10mL 0.1mol/L NaHA溶液中加入0.1mol/L KOH溶液V mL恰好反应溶液显碱性,若溶液为中性需要KOH的量少于NaHA,$\frac{c({K}^{+})}{c(N{a}^{+})}$比值小于1,溶液中电荷守恒等式是阴阳离子间存在的电荷守恒.
解答 解:(1)由HA-?H++A2-可知,Na2A为强碱弱酸盐,A2-水解显碱性,水解离子反应为A2-+H2O?HA-+OH-,
故答案为:碱;A2-+H2O?HA-+OH-;
(2)由HA-?H++A2-可知,Na2A为强碱弱酸盐;NaHA为酸式盐,H2A第一步完全电离,所以HA-只电离,不发生水解,HA-电离生成氢离子,所以溶液显酸性;
故答案为:酸;HA-只电离,不发生水解;
(3)0.1mol/L的NaHA溶液的PH=3,HA-═H++A2-,Ka=$\frac{c({H}^{+})c({A}^{2-})}{c(H{A}^{-})}$=$\frac{1{0}^{-3}×1{0}^{-3}}{0.1-1{0}^{-3}}$=10-5,;
故答案为:10-5;
(4)Kw=c(OH-)c(H+)=KW=c2(OH-),c(OH-)=c(H+),溶液呈中性,NaHA溶液显酸性,某温度下,向10mL 0.1mol/L NaHA溶液中加入0.1mol/L KOH溶液V mL,若恰好反应溶液显碱性,若溶液为中性,需要KOH的量少于NaHA,V<10ml,所以$\frac{c({K}^{+})}{c(N{a}^{+})}$比值小于1,此时溶液中存在的阳离子Na+、K+、H+,阴离子为:OH-、HA-、A2-,溶液中存在电荷守恒c(Na+)+c(K+)+c(H+)=c(OH-)+c(HA-)+2c(A2-),
故答案为:中;<;<;c(Na+)+c(K+)+c(H+)=c(OH-)+c(HA-)+2c(A2-).
点评 本题考查了酸碱反应后溶液酸碱性分析判断、电离平衡常数计算、电解质溶液中离子浓度大小比较、注意弱电解质电离平衡的影响因素等知识点,掌握基础是交通工具,题目难度中等.


科目:高中化学 来源: 题型:实验题
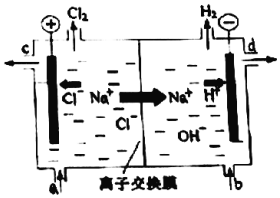 新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液.某研究小组将甲烷燃料电池作为电源,进行惰性电极电解饱和氯化钠溶液实验.回答下列问题:
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液.某研究小组将甲烷燃料电池作为电源,进行惰性电极电解饱和氯化钠溶液实验.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 传感器中通过的电流越大,CO的含量越低 | |
| B. | 工作时电子由电极a通过固体介质NAMCON流向电极b | |
| C. | 工作时电极b作正极,电流由电极a流向电极b | |
| D. | 当固体电解质中有1 mol O2-通过时,电子转移2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ | |
| B. | 向CH3COOH溶液中加入CaCO3:2CH3COOH+CaCO3═2CH3COO-+Ca2++H2O+CO2↑ | |
| C. | 稀硫酸与Ba(OH)2溶液混合:H++SO42-+OH-+Ba2+═BaSO4↓+H2O | |
| D. | NaOH溶液与KHCO3溶液混合:OH-+HCO3-═H2O+CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①④ | D. | 都错误 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加入CCl4,CCl4层显紫色,证明原溶液中存在I- | |
| B. | 将SO2通入品红溶液,溶液褪色,证明SO2具有氧化性 | |
| C. | 配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释 | |
| D. | 将Cl2与HCl混合气体通过饱和食盐水可得到纯净的Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将水加热,pH不变 | |
| B. | 恒温下,向水中加入少量固体KOH,c(OH-)变大 | |
| C. | 向水中滴入稀醋酸,c(H+)增大 | |
| D. | 向水中加入少量固体NaClO,平衡向右移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Si与SiO2在常温下都可与NaOH溶液反应 | |
| B. | C与SiO2之间可以反应制备Si,同时得到CO | |
| C. | Si与SiO2都可以与氢氟酸反应 | |
| D. | Si→SiO2→H2SiO3可以通过一步反应实现 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com