
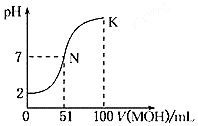
 ³£ĪĀĻĀ£¬Ļņ100mL0.01mol•L-1HAČÜŅŗÖŠÖšµĪ¼ÓČė0.02mol•L-1MOHČÜŅŗ£¬Ķ¼ÖŠĖłŹ¾ĒśĻß±ķŹ¾»ģŗĻČÜŅŗµÄpH±ä»ÆĒéæö£ØČÜŅŗĢå»ż±ä»ÆĪšĀŌ²»¼Ę£©£®ĻĀĮŠĖµ·ØÖŠÕżČ·µÄŹĒ£Ø””””£©
³£ĪĀĻĀ£¬Ļņ100mL0.01mol•L-1HAČÜŅŗÖŠÖšµĪ¼ÓČė0.02mol•L-1MOHČÜŅŗ£¬Ķ¼ÖŠĖłŹ¾ĒśĻß±ķŹ¾»ģŗĻČÜŅŗµÄpH±ä»ÆĒéæö£ØČÜŅŗĢå»ż±ä»ÆĪšĀŌ²»¼Ę£©£®ĻĀĮŠĖµ·ØÖŠÕżČ·µÄŹĒ£Ø””””£©| A£® | øƵĪ¶Ø¹ż³ĢæÉŃ”Ōń·ÓĢŖ×÷ĪŖÖøŹ¾¼Į | |
| B£® | HAµÄµēĄė·½³ĢŹ½ĪŖ£ŗHA?H++A- | |
| C£® | KµćČÜŅŗÖŠ£ŗc £ØMOH£©+c£ØOH-£©-c£ØH+£©=0.01mol•L-1 | |
| D£® | NµćĖ®µÄµēĄė³Ģ¶Č“óÓŚKµćĖ®µÄµēĄė³Ģ¶Č |
·ÖĪö A£®¼īµĪ¶ØĖį£¬Ń”Ōń¼×»ł³ČĪŖÖøŹ¾¼Į£»
B£®ÓÉ0.01mol•L-1HAČÜŅŗpH=2æÉÖŖ£¬ĖįĶźČ«µēĄė£»
C£®KµćĪŖµČĮæµÄMOH”¢MA£¬ÓÉĪļĮĻŹŲŗćæÉÖŖ£¬c £ØMOH£©+c£ØM+£©=0.01mol•L-1£¬ÓɵēŗÉŹŲŗćæÉÖŖc£ØOH-£©-c£ØH+£©=c£ØM+£©-c£ØA-£©£»
D£®NµćĪŖÖŠŠŌ£¬KµćĻŌ¼īŠŌ£¬KµćŅÖÖĘĖ®µÄµēĄė£®
½ā“š ½ā£ŗA£®ÓÉĶ¼æÉÖŖ£¬¼īµĪ¶ØĖį£¬µĪ¶ØÖÕµćĻŌĖįŠŌ£¬Ń”Ōń¼×»ł³ČĪŖÖøŹ¾¼Į£¬¹ŹA“ķĪó£»
B£®ÓÉ0.01mol•L-1HAČÜŅŗpH=2æÉÖŖ£¬ĖįĶźČ«µēĄė£¬ŌņHAµÄµēĄė·½³ĢŹ½ĪŖ£ŗHA=H++A-£¬¹ŹB“ķĪó£»
C£®KµćĪŖµČĮæµÄMOH”¢MA£¬ÓÉĪļĮĻŹŲŗćæÉÖŖ£¬c £ØMOH£©+c£ØM+£©=0.01mol•L-1£¬ÓɵēŗÉŹŲŗćæÉÖŖc£ØOH-£©-c£ØH+£©=c£ØM+£©-c£ØA-£©£¬Ōņc £ØMOH£©+c£ØOH-£©-c£ØH+£©=c £ØMOH£©+c£ØM+£©-c£ØA-£©£¼0.01mol•L-1£¬¹ŹC“ķĪó£»
D£®NµćĪŖÖŠŠŌ£¬KµćĻŌ¼īŠŌ£¬KµćŅÖÖĘĖ®µÄµēĄė£¬ŌņNµćĖ®µÄµēĄė³Ģ¶Č“óÓŚKµćĖ®µÄµēĄė³Ģ¶Č£¬¹ŹDÕżČ·£»
¹ŹŃ”D£®
µćĘĄ ±¾Ģāæ¼²éĖį¼ī»ģŗĻ£¬ĪŖøßĘµæ¼µć£¬°ŃĪÕĖį¼īÖŠŗĶµĪ¶ØĶ¼Ļ󔢵ēŗɼ°ĪļĮĻŹŲŗćÓ¦ÓĆĪŖ½ā“šµÄ¹Ų¼ü£¬²ąÖŲ·ÖĪöÓėÓ¦ÓĆÄÜĮ¦µÄ漲飬עŅāÖøŹ¾¼ĮµÄŃ”Ōń£¬ĢāÄæÄѶČÖŠµČ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Éś»īÖŠŹ¹ÓƵÄĘÆ°×·ŪŗĶ·ŹŌķ¶¼ŹĒ»ģŗĻĪļ | |
| B£® | ŃĢ”¢Īķ”¢¶¹½¬”¢ÓŠÉ«²£Į§¶¼ŹĒ½ŗĢå | |
| C£® | ĘūÓĶŹōÓŚ»ģŗĻĪļ£¬¶ųŅŗĀČ”¢±ł“×Ėį¾łŹōÓŚ“æ¾»Īļ | |
| D£® | ÕįĢĒ”¢ĻõĖį¼ŲŗĶĮņĖį±µ·Ö±šŹōÓŚ·Ēµē½āÖŹ”¢Ēæµē½āÖŹŗĶČõµē½āÖŹ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
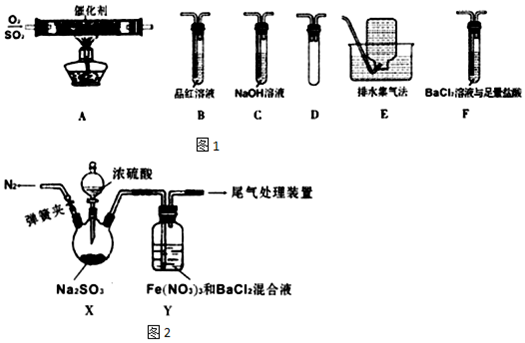
| ŹµŃé²½Öč | ĻÖĻóŗĶ½įĀŪ |
| ¢Ł²ā¶ØYÖŠ»ģŗĻČÜŅŗµÄpH£» ¢ŚÅäÖĘÓė²½Öč¢ŁÓŠĻąĶ¬pHµÄĻ”ĻõĖįÓėBaCl2µÄ»ģŗĻŅŗ£¬²¢ĶØČėŹŹĮæN2£» ¢Ū½«SO2ĶØČė²½Öč¢ŚÖŠČÜŅŗ£® | Čō³öĻÖ°×É«³ĮµķŌņ¼ŁÉč1³ÉĮ¢£¬Čō²»³öĻÖ°×É«³ĮµķŌņ¼ŁÉč1²»³ÉĮ¢£® |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĢģČ»Ęų”¢¾Ę¾«·Ö±šŹōÓŚ»ÆŹÆÄÜŌ“”¢æÉŌŁÉśÄÜŌ“ | |
| B£® | ½šŹōŌŚ³±ŹŖæÕĘųÖŠÉśŠā£¬Ö÷ŅŖŹĒ·¢ÉśĪöĒāøÆŹ“ | |
| C£® | NaClO¾ßÓŠĒæŃõ»ÆŠŌ£¬æÉ×÷ÖÆĪļĘÆ°×¼Į | |
| D£® | øß“æ¹č¹ć·ŗÓ¦ÓĆÓŚĢ«ŃōÄܵē³ŲŗĶ°ėµ¼Ģå²ÄĮĻµÄÖĘŌģ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÖĘŌģĘÕĶز£Į§µÄÖ÷ŅŖŌĮĻŹĒ“æ¼ī”¢ŹÆ»ŅŹÆŗĶŹÆÓ¢ | |
| B£® | Ź¢·ÅÉÕ¼īČÜŅŗµÄŹŌ¼ĮĘæ²»ÄÜÓĆ²£Į§Čū | |
| C£® | ²£Į§ŌŚ¼ÓČČČŪ»ÆŹ±ÓŠ¹Ģ¶ØµÄČŪµć | |
| D£® | ĘÕĶز£Į§µÄÖ÷ŅŖ³É·ÖŹĒ¹čĖįÄĘ”¢¹čĖįøĘŗĶ¶žŃõ»Æ¹č |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā

| A£® | aµē¼«ŹĒøƵē³ŲµÄøŗ¼«£¬·¢ÉśŃõ»Æ·“Ó¦ | |
| B£® | bµē¼«·“Ó¦Ź½ĪŖ2NO3-+10e-+12H+ØTN2”ü+6H2O | |
| C£® | µē³Ų¹¤×÷Ź±£¬H+ÓÉ×óŹŅĶعżÖŹ×Ó½»»»Ä¤½ųČėÓŅŹŅ | |
| D£® | ×Ŗ»ÆŹŅÖŠ·¢Éś·“Ó¦ŗóČÜŅŗµÄpHŌö“ó£ØŗöĀŌĢå»ż±ä»Æ£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com