
分析 (1)硫化钠溶液与氯化铝溶液,相互促进水解生成沉淀和气体;
(2)将NH3通过灼热的CuO,有无色无味的难溶于水的气体生成,是氨气的还原性被氧化铜氧化生成氮气和水;
(3)由电子守恒:n(Co3+)=2 n(Cl2),由电荷守恒:n(Co原子)总=n(Co2+)溶液=$\frac{1}{2}$n(Cl-),联立计算n氧化物(Co2+),根据化合价电荷守恒为0计算氧化物中n(O),进而计算氧化物中n(Co):n(O),结合原子守恒写出化学方程式.
解答 解:(1)将硫化钠溶液与氯化铝溶液混合,有白色沉淀和气体生成是发生了双水解反应生成氢氧化铝沉淀和硫化氢气体,反应的离子方程式为:2Al3++3S2-+6H2O═2Al(OH)3↓+3H2S↑,
故答案为:2Al3++3S2-+6H2O═2Al(OH)3↓+3H2S↑;
(2)将NH3通过灼热的CuO,有无色无味的难溶于水的气体生成,是氨气的还原性被氧化铜氧化生成氮气和水,反应的化学方程式为:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O,
故答案为:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O;
(3)由电子守恒:n(Co3+)=2 n(Cl2)=2×$\frac{6.72L}{22.4L/mol}$=0.6 mol,由电荷守恒:n(Co原子)总=n(Co2+)溶液=$\frac{1}{2}$n(Cl-)=$\frac{1}{2}$×( 0.48L×5mol/L-2×0.3mol)=0.9 mol,所以固体中的n(Co2+)=0.9mol-0.6mol=0.3 mol,根据化合价电荷守恒为0,氧化物中n(O)=(0.3mol×2+0.6mol×3)÷2=1.2mol,故该钴氧化物中n(Co):n(O)=0.9mol:1.2mol=3:4,故氧化物的化学式为:Co3O4,和盐酸反应的化学方程式为Co3O4+8HCl═3CoCl2+Cl2↑+4H2O,
故答案为:Co3O4+8HCl═3CoCl2+Cl2↑+4H2O.
点评 本题考查氧化还原反应,为高频考点,把握水解反应及氧化还原反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意电子守恒的应用,题目难度不大.


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:解答题
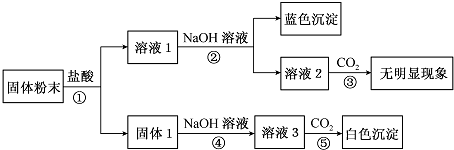
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,K+、Fe2+、I-、Br-可以大量共存 | |
| B. | 和KI溶液反应的离子方程式:Fe3++2I-=Fe2++I2 | |
| C. | 1L0.1mol/L该溶液和足量的Zn充分反应,生成11.2gFe | |
| D. | 和Ba(OH)2溶液反应的离子方程式:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
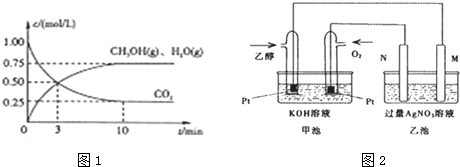
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
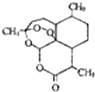 青蒿素是一种高效、速率搞疟药,是中医献给世界的一份礼物.其结构简式如图所示.下列有关青蒿素的说法正确的是( )
青蒿素是一种高效、速率搞疟药,是中医献给世界的一份礼物.其结构简式如图所示.下列有关青蒿素的说法正确的是( )| A. | 易溶于乙醚等有机溶剂 | B. | 分子式为C15H21O5 | ||
| C. | 能在热的NaOH溶液中存在 | D. | 分子结构中含有极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
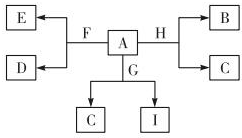 如图是中学化学某些物质之间的相互转化关系,已知A是种常见的液态化合物,C、D、G、H均为单质,G、H形成的合金是当前使用量最大的一种合金,B是黑色固体.
如图是中学化学某些物质之间的相互转化关系,已知A是种常见的液态化合物,C、D、G、H均为单质,G、H形成的合金是当前使用量最大的一种合金,B是黑色固体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
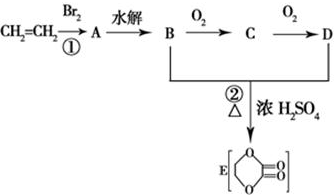
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把苯甲酸、甲醇、稀硫酸混合置于有回流设备的装置中,加热,合成苯甲酸甲酯 | |
| B. | 把苯和少量溴水及少量铁屑放在用带导管的瓶塞塞紧瓶口的烧瓶里,反应制取溴苯 | |
| C. | 把醋酸钠晶体(CH3COONa•3H2O)与干燥的碱石灰按一定比例混合后,加热,制取甲烷 | |
| D. | 把浓硝酸、浓硫酸、苯的混合液放在60℃的水浴中反应,制取硝基苯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com