
【题目】【选修3:物质结构与性质】X、Y、M、Z、R为前四周期元素,且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成XH3;M是周期表中电负性最大的元素;Z基态原子的M层是K层电子数的3倍;R2+离子的3d轨道中有9个电子。请回答下列问题:
(1)基态Y原子的价电子排布图是___________;Z所在周期中第一电离能最大的主族元素是___________(元素名称)。
(2)XY2离子的立体构型是___________;R2+的水合离子[R(H2O)4]2+中,提供孤电子对的原子是___________(元素符号)。
(3)已知XH3易与R2+形成配离子,但XM3不易与R2+形成配离子,其原因是______________________。
(4)Y与R所形成的化合物晶体晶胞如下图所示,该晶体的化学式:___________;晶胞参数如下图所示,则该晶胞密度是___________g·cm-3(列式并计算结果,保留小数点儿后一位)。

(5)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是___________(填标号)。

a.CF4b.CH4c.NH4+d.H2O
【答案】(1)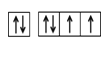 氯(1分)
氯(1分)
(2)V形 O
(3)N、F、H三祌元素的电负性,F > N > H,所以NH3中共用电子对偏向N,而在NF3中,共用电子对偏向F,偏离N原子
(4)CuO 2.1 (5)C
【解析】试题分析:(1)X、Y、M、Z、R为前四周期元素,且原子序数依次增大,XY2是红棕色气体,则X的N元素;Y是O元素,XY2是NO2;X与氢元素可形成XH3;M是周期表中电负性最大的元素,则M是F元素;Z基态原子的M层是K层电子数的3倍,Z是S元素;R2+离子的3d轨道中有9个电子,则R是Cu元素;(1)基态Y原子的价电子排布图是![]() ;Z是S元素,同一周期的元素,原子序数越大,元素的第一电离能就越大,所以第三周期的元素中第一电离能最大的主族元素是氯元素;(2)NO2-的中心原子N原子含有的孤对电子数是:
;Z是S元素,同一周期的元素,原子序数越大,元素的第一电离能就越大,所以第三周期的元素中第一电离能最大的主族元素是氯元素;(2)NO2-的中心原子N原子含有的孤对电子数是:![]() ,即N原子的价层电子对数是3,电子含有一对孤对电子,因此其离子的立体构型是V形;R2+的水合离子[R(H2O)4]2+中,提供孤电子对的原子是O原子;(3)由于在N、F、H三种元素的电负性:F>N>H,所以在NH3中共用电子对偏向N,而在NF3中,共用电子对偏向F,偏离N原子,所以XH3易与R2+形成配离子,但XM3不易与R2+形成配离子;(4)根据晶胞结构、均摊法可知,在晶胞中含有Cu原子数是8×1/8+2×1/2+4×1/4+1=4,O原子数是4×1=4,因此二者之比为4∶4 = 1∶1,化学式为CuO;该晶体的晶胞是长方体,边长分别是600pm、600pm、700pm,则该晶体的密度是
,即N原子的价层电子对数是3,电子含有一对孤对电子,因此其离子的立体构型是V形;R2+的水合离子[R(H2O)4]2+中,提供孤电子对的原子是O原子;(3)由于在N、F、H三种元素的电负性:F>N>H,所以在NH3中共用电子对偏向N,而在NF3中,共用电子对偏向F,偏离N原子,所以XH3易与R2+形成配离子,但XM3不易与R2+形成配离子;(4)根据晶胞结构、均摊法可知,在晶胞中含有Cu原子数是8×1/8+2×1/2+4×1/4+1=4,O原子数是4×1=4,因此二者之比为4∶4 = 1∶1,化学式为CuO;该晶体的晶胞是长方体,边长分别是600pm、600pm、700pm,则该晶体的密度是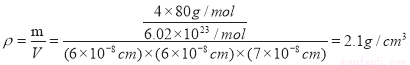 ;(5)在该分子中的四个N原子构成的是正四面体结构,若再分子内的空腔中能嵌入某离子或分子并形成4个氢键予以识别,则应该是含氢化物或离子,其微粒结构也应该是正四面体结构,在选项中的微粒中只有NH4+是正四面体结构,四个氢原子位于正四面体的四个顶点上,答案选C。
;(5)在该分子中的四个N原子构成的是正四面体结构,若再分子内的空腔中能嵌入某离子或分子并形成4个氢键予以识别,则应该是含氢化物或离子,其微粒结构也应该是正四面体结构,在选项中的微粒中只有NH4+是正四面体结构,四个氢原子位于正四面体的四个顶点上,答案选C。


科目:高中化学 来源: 题型:
【题目】在马铃薯幼苗的培养液中,除了必需的微量元素、NH4+、PO43﹣和CO2外,还必需的大量元素有
A. C、H、O、N、P B. K、Ca、Mg、S
C. Mn、Mo、Cu、Zn D. K、Ca、Mg、Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【选修3:物质结构与性质】有A、B、C、D 四种元素,其中 A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p 轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D 的质量分数为40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中A+与D2-离子数之比为 2∶1。请回答下列问题:
(1)A元素形成的晶体内晶胞类型应属于___________(填写“六方” 、 “面心立方” 或“体心立方”)堆积,空间利用率为____________。
(2)C3-的电子排布式为__________,在CB3分子中C元素原子的原子轨道发生杂化,CB3分子的VSEPR模型为_________。
(3)C的氢化物极易溶于水,请解释原因__________________。
(4)D元素与同周期相邻元素的第一电离能由大到小的关系是________________(用元素符号表示);用一个化学方程式说明 B、D两元素形成的单质的氧化性强弱:____________________。
(5)如图所示是R形成的晶体的晶胞,该晶胞与 CaF2晶胞结构相似,设晶体密度是 ρ g·cm-3。R晶体中A+和D2-最短的距离为____________cm。(阿伏加德罗常数用 NA表示,只写出计算式,不用计算)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一份含有FeCl3和FeCl2固体混合物,为测定各成分的含量进行如下两个实验:
实验1:① 称取一定质量的样品,将样品溶解;
② 向溶解后的溶液中加入足量的AgNO3溶液,产生沉淀;
③ 将沉淀过滤、洗涤、干燥得到白色固体17.22 g。
实验2:① 称取与实验1中相同质量的样品,将样品溶解;
② 向溶解后的溶液中通入足量的Cl2;
③ 再向②所得溶液中加入足量的NaOH溶液,得到红褐色沉淀;
④ 将沉淀过滤、洗涤后,加热灼烧,到质量不再减少,得到固体物质4g。
回答下列问题:
(1)溶解过程中所用到的玻璃仪器有___________________。
(2实验室保存FeCl2溶液时通常会向其中加入少量试剂_____________和_____________。
(3)实验2通入足量Cl2的目的是_____________;涉及的化学反应的离子方程式是____________________。
(4检述实验2的步骤④中沉淀已经洗涤干净的方法是_____________。
(5)加热FeCl3溶液,并将溶液蒸干时,通常不能得到FeCl3固体,请以平衡的观点解释其原因(方程式与文字相结合来说明)______________________。
(6)FeCl3溶液可以用于止血,主要是因为FeCl3溶液能使血液聚沉,这涉及胶体的特性。以下关于胶体的说法不正确的是_____________。
A.胶体粒子能透过滤纸,但不能透过半透膜
B.胶体粒子具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象
C.向Fe(OH)3胶体可以产生丁达尔效应,CuSO4溶液、水等分散系不能产生丁达尔效应
D.向Fe(OH)3胶体中滴加硫酸,会先出现红褐色沉淀,随后沉淀消失
E.在蛋白质溶液中加入稀的CuSO4溶液,可使蛋白质盐析
(7)通过实验所得数据,计算固体样品中FeCl3和FeCl2的物质的量之比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学小组用实验的方法进行探究影响化学反应速率的因素。
他们只利用Cu、Fe、Al和不同浓度的硫酸(0.5mol·L-1、2mol·L-1、18.4mol·L-1)。设计实验方案来研究影响反应速率的因素。甲同学研究的实验报告如下表:

(1)甲同学表中实验步骤②为__________________
(2)甲同学的实验目的是__________________
(3)乙同学为了更精确的研究浓度对反应速率的影响,利用下图所示装置进行定量实验。

乙同学在实验中应该测定的数据是______________
(4)乙同学完成该实验应选用的实验药品是________________;该实验中不选用某浓度的硫酸,理由是______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】〔化学—选修3:物质结构与性质〕
早期发现的一种天然准晶颗粒由三种Al、Cu、Fe元素组成。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过 方法区分晶体、准晶体和非晶体。
(2)基态铁原子有 个未成对电子,三价铁离子的电子排布式为: 可用硫氰化钾奉验三价铁离子,形成配合物的颜色为 。
(3)新制备的氢氧化铜可将乙醛氧化为乙酸,而自身还原成氧化亚铜,乙醛中碳原子的杂化轨道类型为 ;一摩尔乙醛分子中含有的σ键的数为: 。乙酸的沸点明显高于乙醛,其主要原因是: 。氧化亚铜为半导体材料,在其立方晶胞内部有四个氧原子,其余氧原子位于面心和顶点,则该晶胞中有 个铜原子。
(4)铝单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为 。列式表示铝单质的密度 g·cm-3(不必计算出结果)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 金属腐蚀就是金属失去电子被还原的过程
B. 铜板上的铁铆钉在潮湿的空气中直接发生反应:Fe- 3e- = Fe3+,继而形成铁锈
C. 将水库中的水闸(钢板)与直流电源的负极相连接,可防止水闸被腐蚀
D. 合金的熔点高于它的任何一种金属成分
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com