
族 周期 | ⅠA | ⅡA | ⅢA | IVA | VA | VIA | VIIA | O族 |
| 1 | ||||||||
| 2 | G | H | D | |||||
| 3 | B | C | E | |||||
| 4 | F | A | ||||||
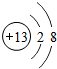 ,G元素的最高价氧化物化学式CO2,H的氢化物的化学式NH3
,G元素的最高价氧化物化学式CO2,H的氢化物的化学式NH3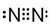 ;
;
分析 由元素在周期表中的位置可知A、B、C、D、E、F、G、H分别为Ca、Na、Al、F、Cl、K、C、N,
(1)C为Al,对应的离子核外有2个电子层,最外层电子数为8,G为C元素,对应的最高价氧化物为二氧化碳,H为N元素,对应氢化物为氨气;
(2)H为N元素,对应单质为氮气,存在N≡N键;
(3)(a)根据元素核外电子层数越多、半径越大,同周期元素从左到右原子半径逐渐减小判断;
(b)元素的金属性越强,单质的还原性越最强;
(c)元素的非金属性越强,对应最高价氧化物对应水化物酸性越强;
(d)元素的金属性越强,对应的最高价氧化物对应水化物碱性越强;
(4)AE2为CaCl2,为离子化合物;
(5)B与C的最高价氧化物对应水化物的分别为氢氧化钠和氢氧化铝,氢氧化铝为两性氢氧化物.
解答 解:由元素在周期表中的位置可知A、B、C、D、E、F、G、H分别为Ca、Na、Al、F、Cl、K、C、N,
(1)C为Al,对应的离子核外有2个电子层,最外层电子数为8,离子的结构示意图为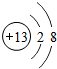 ,
,
G为C元素,对应的最高价氧化物为二氧化碳,化学式为CO2,H为N元素,对应氢化物为氨气,化学式为NH3,
故答案为: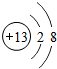 ;CO2;NH3;
;CO2;NH3;
(2)H为N元素,对应单质为氮气,存在N≡N键,电子式为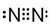 ,故答案为:
,故答案为: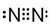 ;
;
(3)(a)元素核外电子层数越多、半径越大,同周期元素从左到右原子半径逐渐减小,可知原子半径最大的为K,故答案为:K;
(b)由元素所在周期表中的位置可知K元素的金属性最强,元素的金属性越强,单质的还原性越最强,故答案为:K;
(c)题中涉及元素中Cl的非金属性最强,对应最高价氧化物对应水化物酸性最强,为HClO4,故答案为:HClO4;
(d)K元素的金属性最强,对应的最高价氧化物对应水化物碱性越强,为KOH,故答案为:KOH;
(4)氯化钙为离子化合物,用电子式表示下列物质的形成过程为 ,
,
故答案为: ;
;
(5)B与C的最高价氧化物对应水化物的分别为氢氧化钠和氢氧化铝,氢氧化铝为两性氢氧化物,反应离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、元素周期律及结构与性质的关系为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
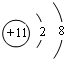 ;1124Na.
;1124Na.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3 平面三角形 sp3杂化 | B. | CCl4 正四面体 sp3杂化 | ||
| C. | H2O V形 sp2杂化 | D. | CO32- 三角锥形 sp3杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
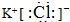 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①③⑥ | C. | ①③⑤ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com