
【题目】(1)写出下列物质溶于水的电离方程式:
HNO3:________________________________________________________;
NH3H2O:_____________________________________________________;
(2)按要求写出方程式。
①铁和稀硫酸(写出离子方程式)_________________________________________;
②氢氧化钡溶液和稀硫酸(写出离子方程式)_______________________________;
③氧化铜和稀盐酸(写出离子方程式)_____________________________________;
④制备氢氧化铁胶体(写出对应的化学方程式)_____________________________;
⑤CO32-+2H+=CO2↑+H2O(写出对应的化学方程式)_____________________________。
【答案】HNO3=H++NO3- NH3H2ONH4++OH- Fe+2H+=Fe2++H2↑ Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O CuO+2H+=Cu2++H2O FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl Na2CO3+2HCl=CO2↑+H2O+2NaCl
Fe(OH)3(胶体)+3HCl Na2CO3+2HCl=CO2↑+H2O+2NaCl
【解析】
(1)①硝酸在水中完全电离,对应的电离方程式为:HNO3=H++NO3-;
②一水合氨在水中部分电离,电离方程式为:NH3H2ONH4++OH-;
(2)①铁和稀硫酸反应产生硫酸亚铁和氢气,所以二者反应的离子方程式为:Fe+2H+=Fe2++H2↑;
②氢氧化钡与稀硫酸反应产生硫酸钡沉淀和水,根据离子方程式书写方法可知对应的离子方程式为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O;
③氧化铜和稀盐酸反应产生氯化铜和水,对应的离子方程式为:CuO+2H+=Cu2++H2O;
④氢氧化铁胶体制备的化学方程式为:FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl;
Fe(OH)3(胶体)+3HCl;
⑤给定离子方程式表示可溶性碳酸盐与可溶性强酸反应产生可溶性盐、二氧化碳和水,因此对应的化学方程式为:Na2CO3+2HCl=CO2↑+H2O+2NaCl。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】低浓度的氢氟酸是一元弱酸,存在下列两个平衡:HF![]() H++F-,HF+F-
H++F-,HF+F-![]() HF2- (较稳定)。25℃时,不同酸性条件下的2.0amol·L-1HF溶液中,c(HF)、c(F-)与溶液pH(忽略体积变化)的变化关系如图所示。下列说法正确的是( )
HF2- (较稳定)。25℃时,不同酸性条件下的2.0amol·L-1HF溶液中,c(HF)、c(F-)与溶液pH(忽略体积变化)的变化关系如图所示。下列说法正确的是( )
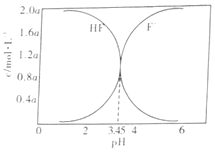
A.c(HF)+c(F-)=2.0amol·L-1
B.c(F-)>c(HF)时,溶液一定呈碱性
C.随着溶液pH增大,![]() 不断增大
不断增大
D.25℃时,HF的电离常数Ka=10-3.45
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为_____________。利用反应6NO2+ 8NH3![]() 7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是________L。
7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是________L。
(2)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0 kJ·mol
2NO2(g) ΔH=-113.0 kJ·mol
则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)的ΔH=_____________kJ·mol-1。一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________。
SO3(g)+NO(g)的ΔH=_____________kJ·mol-1。一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________。
a 体系压强保持不变 b 混合气体颜色保持不变
c SO3和NO的体积比保持不变 d 每消耗1 mol SO3的同时生成1 molNO2
该温度下,此反应的平衡常数表达式K=__________。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应ΔH______0(填“>”或“ <”)。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应ΔH______0(填“>”或“ <”)。
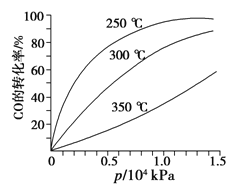
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成气的主要组分为CO和H2;以天然气为原料生产的合成气有多种方法,其中Sparg工艺的原理为CH4(g)+CO2(g)2CO(g)+2H2(g)。在特定温度下,向甲、乙、丙三个密闭容器中充入相同量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如下表所示:
实验编号 | 容器温度/℃ | 容器体积 | 物质浓度/(mol·L-1) | ||
CH4 | CO2 | CO | |||
甲 | 300 | V1 | 0.02 | 0.02 | 0.10 |
乙 | 300 | V2 | x | x | 0.05 |
丙 | 350 | V1 | y | y | 0.12 |
下列说法正确的是( )
A.该反应在低温条件下不能自发进行
B.300 ℃时反应的平衡常数为25
C.V1∶V2=3∶7
D.保持温度和容器体积不变,开始时向甲容器中充入0.28 mol CO和0.28 mol H2,CO转化率一定大于2/7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含苯酚的工业废水的处理流程如图所示。

(1)①流程图设备Ⅰ中进行的是操作________(填写操作名称)。实验室里这一步操作可以用_______(填仪器名称)进行。
②由设备Ⅱ进入设备Ⅲ的物质A是______________(填化学式,下同)。由设备Ⅲ进入设备Ⅳ的物质B是___________。
③在设备Ⅲ中发生反应的化学方程式为_____________________。
④在设备Ⅳ中,物质B的水溶液和CaO反应后,产物是NaOH、H2O和______。通过 _________________(填操作名称)操作,可以使产物相互分离。
⑤图中,能循环使用的物质是_______、_____________C6H6和CaO。
(2)为了防止水源污染,用简单而又现象明显的方法检验某工厂排放的污水中有无苯酚,此方法是____________。
从废水中回收苯酚的方法是①用有机溶剂萃取废液中的苯酚;②加入某种药品的水溶液使苯酚与有机溶剂脱离;③加入某物质又析出苯酚。试写出②、③两步的反应方程式:_________________________。
(3)为测定废水中苯酚的含量,取此废水100 mL,向其中加入浓溴水至不再产生沉淀为止,得到沉淀0.331 g,求此废水中苯酚的含量____________(mg·L-1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1 mol·L1稀盐酸,CO2的生成量与加入盐酸的体积的关系如图。下列判断正确的是( )
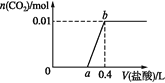
A.在0~a范围内,只发生H++OH-=H2O
B.ab段发生反应的离子方程式为:CO32-+2H+=H2O+CO2↑
C.a=0.2
D.原混合溶液中NaOH与Na2CO3的物质的量之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)糖类、油脂、蛋白质和维生素都是人类的基本营养物质,下表为某品牌燕麦片标签中的一部分。

该燕麦片的营养成分中,能与水反应生成氨基酸的营养物质是_________,每克营养物质氧化时放出能量最多的是_________,一般营养、健康类杂志中提到的“碳水化合物”是指_________,人体必需的微量元素是_________;
(2)维生素C易溶于水,向其水溶液中滴入紫色石蕊试液,石蕊变红色,加热该溶液至沸腾,红色消失,因此,烹调富含维生素C的食物时,应该注意_________;在碱性条件下,维生素C易被空气氧化,烧煮时最好加一点_________;
(3)我们穿的衣服通常是由纤维织成的,常见的纤维有棉花、羊毛、涤纶等.用灼烧法可初步鉴别三种纤维,给三种纤维编号后,分别灼烧产生的气味如下:

则羊毛的编号为_________,棉花的编号为_________,涤纶的编号为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子组在指定溶液中能大量共存的是
A. 常温下,c(H+)/c(OH)=1×1012的溶液:K+、AlO2、CO32、Na+
B. 加入苯酚显紫色的溶液:K+、NH4+、Cl、I
C. 加入Al能放出大量H2的溶液中:NH4+、Na+、NO3、SO42
D. 常温下,pH=7的溶液:Cu2+、Fe3+、NO3、SO42
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的反应路线及所给信息填空:

(1)反应①的类型是__________________,反应⑥的类型是____________________。
(2)C的结构简式是___________________,D的结构简式是___________。
(3)写出反应②的化学方程式:_________________________________________。
(4)反应⑦中,除生成α-溴代肉桂醛的同时,是否还有可能生成其他有机物?若有,请写出其结构简式:_______________________________。(只写一种)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com