
R2O 在一定条件下可以把Mn2+氧化成MnO
在一定条件下可以把Mn2+氧化成MnO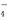 ,若反应中R2O
,若反应中R2O 变为RO
变为RO ,又知反应中氧化剂与还原剂的物质的量之比为5∶2,则n值为( )
,又知反应中氧化剂与还原剂的物质的量之比为5∶2,则n值为( )
A.1 B.2 C.3 D.4
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2017届辽宁省铁岭市协作体高三第三次联考化学试卷(解析版) 题型:选择题
在1200℃时,天然气脱硫工艺中会发生下列反应:
①H2S(g)+ O2(g)═SO2(g)+H2O(g) △H1
O2(g)═SO2(g)+H2O(g) △H1
②2H2S(g)+SO2(g)═ S2(g)+2H2O(g) △H2
S2(g)+2H2O(g) △H2
③H2S(g)+ O2(g)═S(g)+H2O(g )△H3
O2(g)═S(g)+H2O(g )△H3
2S(g)═S2(g)△H4 则△H4的正确表达式为( )
A. △H4= (△H1+△H2﹣3△H3) B. △H4=
(△H1+△H2﹣3△H3) B. △H4=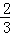 (3△H3﹣△H1﹣△H2)
(3△H3﹣△H1﹣△H2)
C. △H4= (△H1+△H2﹣3△H3) D. △H4=
(△H1+△H2﹣3△H3) D. △H4= (△H1﹣△H2﹣3△H3)
(△H1﹣△H2﹣3△H3)
查看答案和解析>>
科目:高中化学 来源:2017届江西省、兴国三中等四校高三上第一次联考化学卷(解析版) 题型:选择题
把500mLNH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入含amol氢氧化钠的溶液加热,恰好使NH 完全转化为NH3逸出,另取一份加入含bmolHCl的盐酸恰好反应完全,则该混合溶液中c(Na+)为
完全转化为NH3逸出,另取一份加入含bmolHCl的盐酸恰好反应完全,则该混合溶液中c(Na+)为
A.(2b-a) mol/L B.(10b-5a) mol/L
C.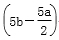 mol/L D.
mol/L D. mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上期中化学试卷(解析版) 题型:实验题
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示(夹持仪器已略去)。

A B
(1)实验前,应先检查装置的 ;实验中产生的尾气应通入 溶液。
(2)实验过程中需要配制100mL1mol/L FeCl3溶液(未用浓盐酸酸化),所需要的玻璃仪器有:烧杯、量筒、胶头滴管、玻璃棒、 。
(3)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色,然后开始实验。
步骤① | 配制1 mol·L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装 |
写出装置A中产生SO2的化学方程式: 。
(4)当SO2通 入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象。将混合液放置12小时,溶液才变成浅绿色。
入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象。将混合液放置12小时,溶液才变成浅绿色。
【查阅资料】 Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+。生成Fe(HSO3)2+离子的反应为可逆反应。
解释SO2与FeCl3溶液反应生成红棕色Fe(HSO3)2+离子的原因(用化学用语解释): 。
写出溶液中Fe(HSO3)2+离子与Fe3+反应的离子方程式:  。
。
(5)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学 进行了步骤③的实验。
进行了步骤③的实验。
步骤② | 往5mL1mol·L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色。微热3 min,溶 |
步骤③ | 往5mL重新配制的1mol·L-1 FeCl3溶液(用浓盐酸酸化)中通入SO |
⑹综合上述实验探究过程,可以获得的实验结论:
I.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
II.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
III. 。
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上期中化学试卷(解析版) 题型:选择题
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z+与Y2-具有相同的电子层结构,W与Y同主族。下列说法正确的是( )
A. 原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X)
B. Z在周期表中的位置为第3周期、IB族
C. X的最高价氧化物对应水化物的酸性比W的弱
D. W比Y更容易与氢气反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省等三校高二上期中化学卷(解析版) 题型:实验题
某废催化剂中主要含SiO2、ZnO、CuS及少量的Fe3O4。某同学以该废催化剂为原料制备皓矾(ZnSO4·7H2O)和蓝矾(CuSO4·5H2O)的实验流程如图所示。

已知:CuS不溶于稀硫酸。
(1)滤渣1的主要成分为________(填化学式)。
(2)实验室用浓H2SO4配制250mL0.50mol/L硫酸溶液时,不需要用到的仪器是________ (填字母)。
A.玻璃棒 B.胶头滴管 C.漏斗 D.容量瓶 e.天平 f.烧杯
(3)现有KMnO4溶液、NaOH溶液、碘水等试剂。用所提供的试剂检验滤液1中是否含有Fe2+的方法为______________。
(4)向盛有滤渣1的反应器中加入硫酸和H2O2溶液时发生反应的化学方程式为____________.(已知滤渣2中含有S)
(5)某同学称取m1废催化剂进行实验,其中CuS的质量分数为x,实验完成之后,得到m2gCuSO4·5H2O,则铜元素的回收率为________________。(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省等三校高二上期中化学卷(解析版) 题型:选择题
下列有关0.10mol/L的NH4Cl溶液的叙述不正确的是
A.c(H+)>c(OH-) B.c(NH4+)<c(Cl一)
C.c(NH4+) +c(H+) =c(Cl-) +c(OH-) D.c(NH4+)+c(Cl-)=0.10mol/L
查看答案和解析>>
科目:高中化学 来源:2016-2017学年青海师大附中高一上期中化学试卷(解析版) 题型:推断题
某无色溶液中可能含有:Na+、Ba2+、Cu2+、CO32-、Cl-、Mg2+。
①向此溶液中滴加稀HCl无明显现象
②取少许①的溶液并加入少量的Na2SO4溶液,有白色沉淀产生
③取②的上层清液并加入过量的NaOH溶液,无明显的现象
请回答下列问题:
(1)原溶液中一定含有的离子是_________,一定不含的离子是_________,不能确定是否含有的离子是__________。
(2)②中的离子方程式是____________________________
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高一上期中化学试卷(解析版) 题型:选择题
对于实验Ⅰ~Ⅳ的描述不正确的是
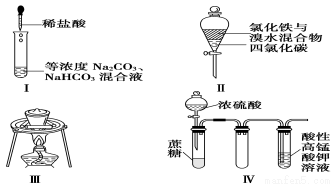
①实验Ⅰ:逐滴滴加稀盐酸时,试管中开始没有立即产生大量气泡
②实验Ⅱ:充分振荡后静置,下层溶液为橙红色,上层无色
③实验Ⅲ:从饱和食盐水中提取氯化钠晶体
④实验Ⅳ:酸性KMnO4溶液中有气泡出现,且溶液颜色逐渐变浅乃至褪去
A.②③ B.①② C.③④ D.①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com