
【题目】下表列出了部分元素在周期表中的位置,请用具体的元素完成下列填空。
族 周期 | ⅠA | 0 | ||||||||||||
1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||||||||
2 | X | Y | G | |||||||||||
3 | Z | …… | H | W | E | Q | ||||||||
(1)上述元素的原子中,得电子能力最强的是______________(填元素名称)。
2)化学性质最不活泼的是___________(填元素符号)。
(3)G对应离子的半径______________Z对应离子的半径(填“<”或“>”)。
(4)写出H与Z的最高价氧化物的水化物溶液反应的离子方程式:________________。
(5)元素X的最高价氧化物的电子式________________,元素W的最高价氧化物为
_______________(填晶体类型)。
(6)为比较元素X和W的非金属性强弱,用下图所示装置进行实验(夹持仪器已略去,装置气密性良好)。溶液B的作用是________________,能说明X和W非金属性强弱的化学方程式是_________________________________。
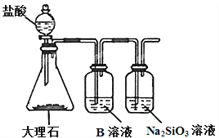
【答案】 氟 Ar ﹥ 2Al + 2OH- +2H2O = 2AlO2-+ 3H2↑ ![]() 原子晶体 吸收CO2中的HCl气体 CO2 + H2O + Na2SiO3 = Na2CO3 + H2SiO3↓
原子晶体 吸收CO2中的HCl气体 CO2 + H2O + Na2SiO3 = Na2CO3 + H2SiO3↓
【解析】由元素在周期表在的位置可知,X为C,Y为N,G为F,Z为Na,H为Al,W为Si,E为Cl,Q为Ar。(1)上述元素中F(氟)的非金属性最强,得电子能力最强;(2)化学性质最不活泼的是Ar;(3)具有相同排布的离子,原子序数大的离子半径小,则Z的原子序数大,其离子半径小,所以G对应离子的半径>Z对应离子的半径;(4)Z的最高价氧化物对应水化物为NaOH,与Al反应生成偏铝酸钠和氢气,反应的离子反应为2Al+2OH﹣+2H2O═2AlO2﹣+2H2↑;(5)元素X的最高价氧化物CO2,其电子式为:![]() ;元素W的最高价氧化物为SiO2,属于原子晶体;(6)比较元素X和W的非金属性强弱,图中装置中发生强酸制取弱酸的反应原理,B中试剂吸收二氧化碳中的HCl,说明X和W非金属性强弱,则装置中最后的试剂瓶中发生二氧化碳与硅酸钠的反应生成硅酸,化学方程式为CO2 + H2O + Na2SiO3 = Na2CO3 + H2SiO3↓。
;元素W的最高价氧化物为SiO2,属于原子晶体;(6)比较元素X和W的非金属性强弱,图中装置中发生强酸制取弱酸的反应原理,B中试剂吸收二氧化碳中的HCl,说明X和W非金属性强弱,则装置中最后的试剂瓶中发生二氧化碳与硅酸钠的反应生成硅酸,化学方程式为CO2 + H2O + Na2SiO3 = Na2CO3 + H2SiO3↓。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】(1)一定条件下,向容积为2L的恒容密闭容器中充入1 mol CH3OH(g)和3 mol H2O(g),CH3OH(g) + H2O(g)![]() CO2(g) + 3H2(g)
CO2(g) + 3H2(g) ![]() H(298K)=+ 49.4 kJ/mol。实验测得:达到平衡状态时,吸收热量19.76 kJ。则
H(298K)=+ 49.4 kJ/mol。实验测得:达到平衡状态时,吸收热量19.76 kJ。则
①达平衡时混合气体的压强是反应前的 倍。
②该条件下反应达平衡状态的依据是(填序号) 。
A.v正(CH3OH)=v正(CO2) B.混合气体的密度不变
C.c(CH3OH)=c(H2O) D.混合气体的总物质的量不变
(2)在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热Q kJ。则表示甲醇燃烧热的热化学方程式为_____________________。
(3)对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:

①定性分析:如图甲可通过观察__________________,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是___________。
②定量分析:用图乙所示装置做对照实验,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。检查该装置气密性的方法是 ,实验中需要测量的数据是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下反应中属于放热反应的是
A. 氢氧化钾与硝酸反应 B. 焦炭在高温下与水蒸气反应
C. 石灰石分解成氧化钙和二氧化碳 D. Ba(OH)2·8H2O与NH4Cl的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应与能量的说法正确的是 ( )
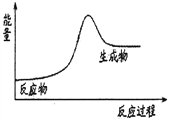
A. 放热反应在常温下一定很容易发生
B. 化学反应一定既伴随着物质变化又伴随着能量变化
C. 石灰石分解反应的能量变化可以用右图3表示
D. 反应物所具有的总能量高于生成物所具有的总能量的反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用下图装置完成了O元素的非金属性比S强的实验研究。
回答下列问题:
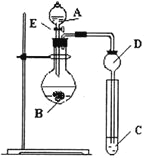
(1)图中D装置名称是 。
(2)从以下所给物质中选出甲同学设计的实验所用到物质:
①稀HNO3溶液②稀盐酸③碳酸钙④Na2SiO3溶液⑤SiO2
试剂A为_________;试剂C为_________(填序号)。
(3)乙同学设计的实验所用到试剂A为________;试剂C为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:

(1)MgCO3与稀硫酸反应的离子方程式为 。
(2)加入H2O2氧化时,发生反应的化学方程式为 。
(3)滤渣2的成分是 (填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C ![]() 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C![]() MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C![]() MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用下图装置对煅烧产生的气体进行分布吸收或收集。
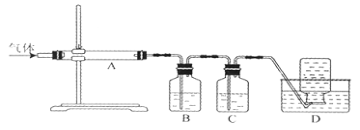
①D中收集的气体是 (填化学式)。
②B中盛放的溶液可以是 (填字母)。
a.NaOH溶液 B.Na2CO3溶液 C.稀硝酸 D.KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明氢氟酸是弱酸的实验事实是
A.HF溶液与Zn反应放出H2
B.0.1mol/LNaF溶液的pH大于7[
C.HF溶液与Na2CO3反应生成CO2
D.0.1mol/LHF溶液可使紫色石蕊变红
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com