
����Ŀ����ҵ�ϳ��Ի�ͭ��(��Ҫ�ɷ���CuFeS2)Ϊԭ���Ʊ�ͭ�Լ�����������(Fe2O3)�����ַ�������ʵ��ͭ��ұ�����乤��������ͼ��
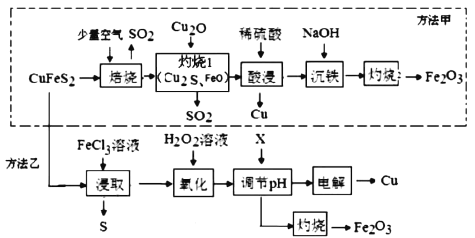
�ش��������⣺
(1)Ϊʹ����������Ӧ��ֽ��У���ҵ�Ͽɲ�ȡ�Ĵ�ʩ��____(дһ��)��д����������ʱ��Ӧ�Ļ�ѧ����ʽ��___��
(2)������1�����������������õ�������____��
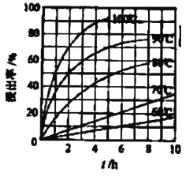
(3)FeCl3��Һ����ȡ��ʱ��ͭ�Ľ����ʽ����ͼ��ʾ����ͼ��֪����ͭ�Ľ�����Ϊ90%ʱ�������õ�ʵ������Ϊ____��д���ù�������Ӧ�����ӷ���ʽ��______��
(4)������pH�������Լ�X��_____���ù����Ŀ���dz�ȥ��Һ�е�Fe3������������Һ��pH=3.5ʱ��Fe3��______(������������������)������ȫ[c(Fe3��)��1��10��5molL��1ʱ����ΪFe3��������ȫ]������Һ��c(Cu2��)=0.2molL��1����ʱ�Ƿ���Cu(OH)2����?_______(��ʽ����)��{��֪��25��ʱ��Ksp[Fe(OH)3]��1.0��10��39��Ksp[Cu(OH)2]��2.2��10��20}
(5)�����ұȷ������ã���ԭ����_____(дһ��)��
���𰸡�������� 2CuFeS2+ 4O2![]() Cu2S+3SO2+2FeO Cu2S��Cu2O 4h��100�� CuFeS2+ 4 Fe3+= Cu2++5 Fe2++2S CuO �� ����Qc= c(Cu2+)c2(OH-)=0.2��(10-10.5)2=2��10-22��Ksp[Cu(OH)2]��2.2��10��20����Cu(OH)2���� �����������в�����SO2����Ⱦ����
Cu2S+3SO2+2FeO Cu2S��Cu2O 4h��100�� CuFeS2+ 4 Fe3+= Cu2++5 Fe2++2S CuO �� ����Qc= c(Cu2+)c2(OH-)=0.2��(10-10.5)2=2��10-22��Ksp[Cu(OH)2]��2.2��10��20����Cu(OH)2���� �����������в�����SO2����Ⱦ����
��������
(1)����Ӱ�컯ѧ��Ӧ���ʵ����ط�����𣻸�������ͼ����������ʱCuFeS2������е�O2��Ӧ����Cu2S��SO2��FeO���ݴ���д��Ӧ�ķ���ʽ��
(2)��������ͼ��������1�������У�Cu2S��Cu2O��FeO��Ӧ������SO2��Fe2O3��Cu�����������ԭ��Ӧ�Ĺ��ɷ����жϣ�
(3)����ͼ��FeCl3��Һ����ȡ��ʱ����ͭ�Ľ�����Ϊ90%ʱ�������õ�ʵ������Ϊ4h��100�棻�ù�������У�FeCl3���������ԣ�CuFeS2��FeCl3��Һ��Ӧ������S����ϻ��ϼ۵ı仯�������ж��������������д��Ӧ�ķ���ʽ��
(4)������������Ŀ���ǽ����������������������ӣ�����pH��ʹ�����ӳ������Ӳ������µ����ʽǶȷ����жϿ���ʹ�õ��Լ�����������Һ��pH=3.5ʱ��c(OH-)=1��10��10.5molL��1�������ܶȻ����������c(Fe3��)�����Ƿ�С�ڻ����1��10��5molL��1�жϣ�����Һ��c(Cu2��)=0.2molL��1������Qc��Ksp[Cu(OH)2]�Ĵ�С�жϣ�
(5)��������ͼ�������������в�����SO2����Ⱦ�����������������������ɵ�S��������ɻ�����Ⱦ��
(1)Ϊʹ����������Ӧ��ֽ��У���ҵ�Ͽɲ�ȡ�Ĵ�ʩ�н���ͭ����顢��߷�Ӧ�¶ȵȷ�������������ͼ����������ʱ��Ӧ�Ļ�ѧ����ʽΪ2CuFeS2+ 4O2![]() Cu2S+3SO2+2FeO���ʴ�Ϊ��������壻2CuFeS2+ 4O2
Cu2S+3SO2+2FeO���ʴ�Ϊ��������壻2CuFeS2+ 4O2![]() Cu2S+3SO2+2FeO��
Cu2S+3SO2+2FeO��
(2)��������ͼ��������1�������У�Cu2S��Cu2O��FeO��Ӧ������SO2��Fe2O3��Cu����Ӧ��CuԪ�صĻ��ϼ۽��ͣ�FeԪ�غ�SԪ�صĻ��ϼ����ߣ����������õ������ǣ��ʴ�Ϊ��Cu2S��Cu2O��
(3)����ͼ��FeCl3��Һ����ȡ��ʱ����ͭ�Ľ�����Ϊ90%ʱ�������õ�ʵ������Ϊ4h��100�棻�ù�������У�FeCl3���������ԣ�CuFeS2��FeCl3��Һ��Ӧ������S��ͬʱ�������Ȼ�ͭ���Ȼ�������������Ӧ�����ӷ���ʽΪCuFeS2+ 4 Fe3+= Cu2++5 Fe2++2S���ʴ�Ϊ��4h��100�棻CuFeS2+ 4 Fe3+= Cu2++5 Fe2++2S��
(4)����(3)�з�Ӧ�ķ���ʽ��֪��������������Ŀ���ǽ����������������������ӣ�����pH��ʹ�����ӳ�����Ϊ�˲������µ����ʣ�����ѡ������ͭ��̼��ͭ�ȵ�����Һ��pH��ȥ��Һ�е�Fe3������������Һ��pH=3.5ʱ��c(OH-)=1��10��10.5molL��1����c(Fe3��)=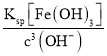 =
=![]() = 1��10��7.5molL��1��1��10��5molL��1��Fe3����ȫ����������Һ��c(Cu2��)=0.2molL��1����Qc= c(Cu2+)c2(OH-)=0.2��(10-10.5)2=2��10-22��Ksp[Cu(OH)2]��2.2��10��20����Cu(OH)2�������ʴ�Ϊ��CuO���ǣ�����Qc= c(Cu2+)c2(OH-)=0.2��(10-10.5)2=2��10-22��Ksp[Cu(OH)2]��2.2��10��20����Cu(OH)2������
= 1��10��7.5molL��1��1��10��5molL��1��Fe3����ȫ����������Һ��c(Cu2��)=0.2molL��1����Qc= c(Cu2+)c2(OH-)=0.2��(10-10.5)2=2��10-22��Ksp[Cu(OH)2]��2.2��10��20����Cu(OH)2�������ʴ�Ϊ��CuO���ǣ�����Qc= c(Cu2+)c2(OH-)=0.2��(10-10.5)2=2��10-22��Ksp[Cu(OH)2]��2.2��10��20����Cu(OH)2������
(5)�����������в�����SO2����Ⱦ�����������������������ɵ�S��������ɻ�����Ⱦ����˷����ұȷ������ã��ʴ�Ϊ�������������в�����SO2����Ⱦ������


 ��Կ���Ծ�ϵ�д�
��Կ���Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Է�ӦA+B=AB��˵�������°�����������з�Ӧ��
��20mL��Һ�к�A��B��0.01mol�� ��50mL��Һ�к�A��B��0.05mol
��0.1molL��1��A��B��Һ��10mL ��0.5molL��1��A��B��Һ��50mL
���߷�Ӧ���ʵĴ�С��ϵ��
A. �������������� B. ��������������
C. �������������� D. ��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25��ʱ����l0mL0.01mol��L-1NaA��Һ����μ���0.01mol��L-1�����ᣬ�ζ���������ͼ��ʾ������˵����ȷ���ǣ� ��

A. a�㵽c��Ĺ����У�c(HA)+c(A-)=0.01mol��L-1��ʽʼ�ճ���
B. b��ʱ����Һ����Ũ�ȴ�С�Ĺ�ϵ��c(A-)>c(Cl-)>c(HA)>c(OH-)>c(H+)
C. c����Һ���ڵĹ�ϵ��c(Na+)+c(H+)=c(HA)+c(OH-)+2c(A-)
D. ��ͼ��֪����Ũ�ȵ�HA��NaA�����Һ�У�HA�ĵ���̶ȴ���A-��ˮ��̶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�о�ij��Һ������R�ķֽ����ʵ�Ӱ���������ֱ������ݲ�ͬ��ʼŨ�ȵ�R��Һ�ڲ�ͬ�¶��½���ʵ����c(R)��ʱ��仯��ͼ������˵������ȷ����(����)
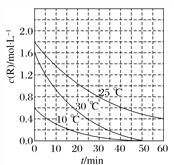
A. 25 ��ʱ����0��30 min����R�ķֽ�ƽ���ٶ�Ϊ0.033 mol��L��1��min��1
B. �Ա�30 ����10 ����������50 minʱ��R�ķֽ�ٷ������
C. �Ա�30 ����25 ����������0��50 min������˵��R�ķֽ�ƽ���ٶ����¶����߶�����
D. �Ա�30 ����10 ����������ͬһʱ������˵��R�ķֽ��������¶����߶�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��Ч�������������ػ�����ȡ��ʩ���ƴ����������о�����Ч���ƿ����еĵ������̼�����ﺬ���Ե���Ϊ��Ҫ��
�������������о�
��1��һ�������£���2molNO��2molO2���ں����ܱ������з�����Ӧ2NO(g)+O2(g)![]() 2NO2(g)�����и�����˵����Ӧ�ﵽƽ��״̬����____________��
2NO2(g)�����и�����˵����Ӧ�ﵽƽ��״̬����____________��
a����ϵѹǿ���ֲ��� b����������ܶȱ��ֲ���
c��NO��O2�����ʵ���֮�ȱ��ֲ��� d��ÿ����2molNOͬʱ����2 molNO2
��2��������ȼ������ʱ������N2��O2�ķ�Ӧ��N2+ O2![]() 2NO���ǵ�������β���к���NO��ԭ��֮һ����T1��T2�¶��£�һ������NO�����ֽⷴӦʱN2�����������ʱ��仯����ͼ��ʾ������ͼ���жϷ�ӦN2��g��+ O2��g��
2NO���ǵ�������β���к���NO��ԭ��֮һ����T1��T2�¶��£�һ������NO�����ֽⷴӦʱN2�����������ʱ��仯����ͼ��ʾ������ͼ���жϷ�ӦN2��g��+ O2��g��![]() 2NO��g���ġ�H____0(����������������)��
2NO��g���ġ�H____0(����������������)��

��3��NOx������β���е���Ҫ��Ⱦ��֮һ����������������ʱ������N2��O2��Ӧ��
�������仯��ͼ��ʾ��
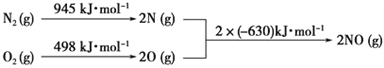
д���÷�Ӧ���Ȼ�ѧ����ʽ��________________________________��
������������͵����������dz��õĻ���ԭ������Ҳ�Ǵ�������Ҫ��Ⱦ��ۺ���������Ⱦ�ǻ�����ѧ��ǰ����Ҫ�о�����֮һ��
��1�����������У�SO2����������SO3��2SO2(s)+O2��g��![]() 2SO3��g����ij�¶��£�SO2��ƽ��ת����(��)����ϵ��ѹǿ(P)�Ĺ�ϵ����ͼ��ʾ������ͼʾ�ش��������⣺
2SO3��g����ij�¶��£�SO2��ƽ��ת����(��)����ϵ��ѹǿ(P)�Ĺ�ϵ����ͼ��ʾ������ͼʾ�ش��������⣺
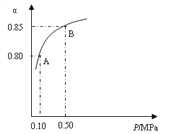
�ٽ�2.0 molSO2��1.0molO2����10 L�ܱ������У���Ӧ��ƽ�����ϵ��ѹǿΪ0.10MPa���÷�Ӧ��ƽ�ⳣ������__________��
��ƽ��״̬��A�䵽Bʱ��ƽ�ⳣ��K��A��_______K(B)(���������������=��)��
��2����CH4����ԭNOx�������������������Ⱦ��������
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ��H=-574kJ��mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ��H=-1160kJ��mol-1
���ñ�״����4.48 L CH4��ԭNO2��N2������������ת�Ƶĵ�������Ϊ__________(�����ӵ�������ֵ��NA��ʾ)���ų�������Ϊ___________kJ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����(Se)�Ƕ�������Ӫ��Ԫ�غ�ֲ�������Ӫ��Ԫ�أ������γ�SeO2��H2SeO3��H2SeO4�Ȼ����
(1)����ԭ�ӽṹʾ��ͼ�ɱ�ʾΪ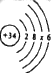 ����x��ֵΪ_____��
����x��ֵΪ_____��
(2)����������Һ��ͨ����������е�����������д���÷�Ӧ�Ļ�ѧ����ʽ�� _______��
(3)��֪��Se(s)��H2(g)��2O2(g)=H2SeO4(s) ��H1��
H2(g)��![]() O2(g)=H2O(l) ��H2��
O2(g)=H2O(l) ��H2��
2SeO2(g)��O2(g)��2H2O(l)=2H2SeO4(s) ��H3��
��ӦSe(s)��O2(g)=SeO2(g)����H��____��(�ú���H1����H2����H3�Ĵ���ʽ��ʾ)
(4)�¶�ΪT��ʱ����2.0L�����ܱ������г���1.0molH2SeO3(g)��������Ӧ��H2SeO3(g)![]() SeO2(g)+H2O(g) ��H=��a kJ/mol��0��10min�����������¶Ȳ��䣬10minʱ�ı�һ������������������H2SeO3(g)��SeO2(g)��H2O(g)�����ʵ�����ʱ��ı仯��ͼ��ʾ��
SeO2(g)+H2O(g) ��H=��a kJ/mol��0��10min�����������¶Ȳ��䣬10minʱ�ı�һ������������������H2SeO3(g)��SeO2(g)��H2O(g)�����ʵ�����ʱ��ı仯��ͼ��ʾ��
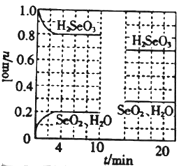
��Ҫ���ƽ��ʱSeO2������������ɲ�ȡ�Ĵ�ʩ��______(����ĸ)��
a.����������䣬���߷�Ӧ�¶�
b.ʹ�ø�Ч����
c.�¶Ⱥ��ݻ����䣬��СH2SeO3����ʼ��
d.�¶Ȳ��䣬ѹ���������������ѹǿ
��0��4min��ƽ����Ӧ����v(H2O)=______��
��10minʱ�ı��������_____��
���¶�ΪT��ʱ���÷�Ӧ��ƽ�ⳣ��KΪ______������ʼʱ��������г���2.0mol H2SeO3(g)��1.0 mol SeO2(g)��0.15 mol H2O(g)����Ӧ�ﵽƽ��ǰ��v(��)____(������������С��������������)v(��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������������ȷ����
A. 1.0 mol NaCl�������NA��NaCl����
B. 1 mol OH����1mol��OH(�ǻ�)�к��е���������Ϊ9NA
C. ��״���£�0.1molCl2����ˮ��ת�Ƶĵ�����ĿΪ0.1NA
D. 1L0.2molL��1��NaHCO3��Һ��HCO3����CO32��������֮��Ϊ0.2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�п��ܺ�������6�������е�ij���֣�Cl����SO42-��CO32-��NH4+��Na����K����Ϊȷ����Һ��ɽ�������ʵ�飺(1) 200 mL������Һ����������BaCl2��Һ����Ӧ�������ˡ�ϴ�ӡ�����ó���4.30 g��������м�����������ᣬ��2.33 g�������ܡ�(2) ��(1)����Һ�м���������NaOH��Һ�����ȣ���״���²�����ʹʪ���ɫʯ����ֽ����������1.12 L���ɴ˿��Եó�����ԭ��Һ��ɵ���ȷ������
A. һ������SO42-��CO32-��NH4+�����ܴ���Cl����Na����K��
B. һ������SO42-��CO32-��NH4+��Cl����һ��������Na����K��
C. c(CO32-)��0.01mol��L��1��c(NH4+)��c(SO42-)
D. �������6�����Ӷ����ڣ���c(Cl��)��c(SO42-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)�л��� ��ϵͳ������________________________________________________________________________��
��ϵͳ������________________________________________________________________________��
�����ڴ�����������ȫ�⻯������������ϵͳ������________________________________________________________________________��
(2)�л���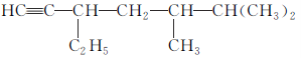 ��ϵͳ������________________________________________________________________________��
��ϵͳ������________________________________________________________________________��
�����ڴ�����������ȫ�⻯������������ϵͳ������________________________________________________________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com